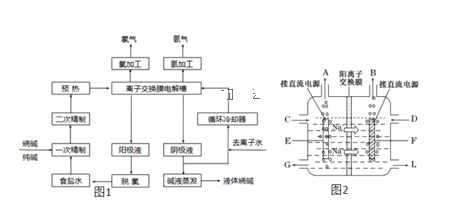
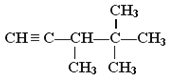
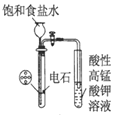
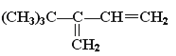��Ŀ����
����Ŀ����1��800��ʱ��ij�ܱ������д������·�Ӧ��2NO2(g) ![]() 2NO(g) + O2(g) ��H��0������ʼ�������м���1mol/L��NO2����Ӧ������NO��Ũ����ʱ��ı仯��ͼ����I��ʾ
2NO(g) + O2(g) ��H��0������ʼ�������м���1mol/L��NO2����Ӧ������NO��Ũ����ʱ��ı仯��ͼ����I��ʾ
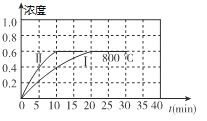
�ٷ�Ӧ������ڷ�ӦI���ԣ��ı������������_______________��
��800��ʱ������ʼʱ��������ͬʱ����1mol/LNO��0.2mol/LO2��0.5mol/L NO2����v��____________v��������<������>������=����
��2����֪N2O4(g) ![]() 2NO2(g) ��H=+57.20kJ/mol��t minʱ����һ������NO2��N2O4������һ������Ϊ2L�ĺ����ܱ������У�Ũ����ʱ��仯��ϵ���±���ʾ��
2NO2(g) ��H=+57.20kJ/mol��t minʱ����һ������NO2��N2O4������һ������Ϊ2L�ĺ����ܱ������У�Ũ����ʱ��仯��ϵ���±���ʾ��
ʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c��X��/��mol/L�� | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
c��Y����mol/L�� | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
��c(X)����__________���ѧʽ����Ũ�ȣ��÷�Ӧ��ƽ�ⳣ��K=_____________��
��ǰ10min����NO2Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ___________��20minʱ�ı��������_____________�����´ﵽƽ��ʱ��NO2����������___________________��
a������ b����С
c������ d�����ж�
���𰸡�������� < NO2 0.9mol/L 0.04mol/(L��min) ����0.8molNO2 b
��������
���⿼����������ԭ������ѧƽ�ⳣ���ļ��㡢��ѧ��Ӧ���ʵļ��㣬��1��������ͼ�ﵽƽ���NO��Ũ����ȣ���II�ķ�Ӧ���ʱ�I�죬˵��ʹ���˴�������800��ʱ����ѧƽ�ⳣ��K= 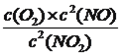 ���ﵽƽ���c(NO)=0.6mol��L��1��c(O2)=0.3mol��L��1��c(NO2)=0.4mol��L��1��������������ʽ��K=0.675������ʼʱ��������ͬʱ����1mol��L��1NO��0.2mol��L��1O2��0.5mol��L��1 NO2����ʱQc=
���ﵽƽ���c(NO)=0.6mol��L��1��c(O2)=0.3mol��L��1��c(NO2)=0.4mol��L��1��������������ʽ��K=0.675������ʼʱ��������ͬʱ����1mol��L��1NO��0.2mol��L��1O2��0.5mol��L��1 NO2����ʱQc=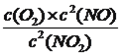 =0.8>0.625��˵���˷�Ӧ���淴Ӧ������У�v��<v�棻��2���ٸ��ݱ������ݣ�10minʱ�ﵽƽ�⣬X���ɵ�Ũ��Ϊ0.4mol��L��1��Y����Ũ��Ϊ0.2mol��L��1�����ݷ�Ӧ����ʽ��XΪNO2��YΪN2O4����ѧƽ�ⳣ��K=
=0.8>0.625��˵���˷�Ӧ���淴Ӧ������У�v��<v�棻��2���ٸ��ݱ������ݣ�10minʱ�ﵽƽ�⣬X���ɵ�Ũ��Ϊ0.4mol��L��1��Y����Ũ��Ϊ0.2mol��L��1�����ݷ�Ӧ����ʽ��XΪNO2��YΪN2O4����ѧƽ�ⳣ��K=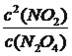 =0.62/0.4=0.9�������ݻ�ѧ��Ӧ���ʵ���ѧ����ʽ��v(NO2)=(0.6��0.2)/10mol/(L��min)=0.04 mol/(L��min)��20minʱ��N2O4��Ũ��û�з����仯��NO2��Ũ�����ӣ���˸ı������ʱ����0.8molNO2���ٳ���0.8molNO2���൱����ԭ���Ļ���������ѹǿ��ƽ�����淴Ӧ�����ƶ�������NO2����NO2������������С����b��ȷ��
=0.62/0.4=0.9�������ݻ�ѧ��Ӧ���ʵ���ѧ����ʽ��v(NO2)=(0.6��0.2)/10mol/(L��min)=0.04 mol/(L��min)��20minʱ��N2O4��Ũ��û�з����仯��NO2��Ũ�����ӣ���˸ı������ʱ����0.8molNO2���ٳ���0.8molNO2���൱����ԭ���Ļ���������ѹǿ��ƽ�����淴Ӧ�����ƶ�������NO2����NO2������������С����b��ȷ��