��Ŀ����
I�������ڵؿ��й㷺�ֲ���Ԫ��֮һ���䵥�ʺͻ������ڹ�ũҵ������������Ҫ�����á���֪Al��ȼ����Ϊ��H=��ckJ��mol��1�������̿������ȷ��Ƶá���������Ȼ�ѧ����ʽΪ��3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s) ��H1 = akJ��mol��1
3MnO2(s)=Mn3O4(s)+O2(g) ��H2 = b kJ��mol��1
��3MnO2(s)+4Al(s)=3Mn(s)+2Al2O3(s) ��H3 =__________kJ��mol��1���ú�a��b��c��ʽ�ӱ�ʾ��
II�������л��軯���ڹ�ũҵ������Ӧ�ù㷺��������ұ��ҵ�����軯������ˮ�Ĵ����Ե���Ϊ��Ҫ�������ˮ�е��軯�ﳣ��[Fe(CN)6]3-��CN-����ʽ���ڣ���ҵ���ж��ַ�ˮ����������
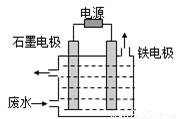
��1��������������ͼ��ʾװ�ô�����CN����ˮʱ��������ҺpHΪ9~10������NaCl��һ�������µ�⣬����������ClO����CN������Ϊ�����ʶ���ȥ�����缫Ϊ__________�����������������������������ClO���ĵ缫��ӦΪ__________������������ClO����CN������Ϊ�����ʶ���ȥ�����ӷ���ʽΪ__________��
��2��UV��������ߵļ�ƣ���H2O2��������
ʵ����̣�ȡһ���������ˮ������pH������һ�����ʵ�����H2O2������UV����װ���У�����һ��ʱ���ȡ��������
���������ϡ�
����ǿ������Һ��4[Fe(CN)6]3��+4OH��=4[Fe(CN)6]4��+O2��+2H2O��[Fe(CN)6]4�����ȶ���
��[Fe(CN)6]3��ת��ΪCN�����ױ�H2O2��ȥ��
��HCN���ж������ᣬ�ӷ���
�ٷ�ˮ�е�CNһ�����·�Ӧʵ��ת����CN��+H2O2+H2O=A+NH3������A��__________���÷��ű�ʾ����
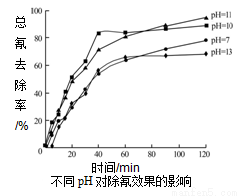
�ں����ˮ�ڲ�ͬpH�µij���Ч����ͼ��ʾ��pHѡ�����ѷ�ΧӦΪ__________(a��7-10��b��10-11��c��11-13)������pH����̫���ԭ��__________��
һ���¶��£������������Ϊ0.5 L�ĺ����ܱ������з�����Ӧ��
CO(g)+Cl2(g) COCl2(g)
COCl2(g)
������������5 minʱ����ƽ�⡣
������� | �¶�/�� | ��ʼ���ʵ���/mol | ƽ�����ʵ���/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
�� | 500 | 1.0 | 1.0 | 0 | 0.8 |
�� | 500 | 1.0 | a | 0 | 0.5 |
�� | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
����˵����ȷ����
A. ��������ǰ5 min��ƽ����Ӧ����v(CO)=0.16 mol��L-1��min-1
B. �÷�Ӧ������ӦΪ���ȷ�Ӧ
C. ����������ʼʱCl2�����ʵ���Ϊ0.55 mol
D. ����ʼʱ���������м���CO 0.8 mol��Cl2 0.8 mol���ﵽƽ��ʱCO��ת���ʴ���80%




 ��CH2CH2OH)Ϊԭ�ϣ����Լ���ѡ��������Ʊ������(
��CH2CH2OH)Ϊԭ�ϣ����Լ���ѡ��������Ʊ������(


 �ȡ��������������Bԭ������ҵȾ��Nԭ�ӵ��������Ϊ____________________ ��
�ȡ��������������Bԭ������ҵȾ��Nԭ�ӵ��������Ϊ____________________ ��