题目内容
常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+)0.2mol/L HCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(H+)-c(MOH)= mol/L.
①混合溶液中由水电离出的c(H+)0.2mol/L
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(H+)-c(MOH)=
考点:酸碱混合时的定性判断及有关ph的计算,水的电离,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:如MOH为强碱,则室温下取0.2mol?L-1HCl溶液与0.2mol?L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),pH应为7,而测得混合溶液的pH=6,说明得到的盐是强酸弱碱盐,其溶液呈酸性,含有弱根离子的盐促进水电离,根据物料守恒和电荷守恒计算离子浓度大小.
解答:
解:①等体积等浓度的盐酸和MOH恰好反应生成盐,得到的盐溶液呈酸性,说明该盐是强酸弱碱盐,含有弱根离子的盐促进水电离,酸抑制水电离,所以混合溶液中水电离出的c(H+)>0.2 mol?L-1 HCl溶液中水电离出的c(H+),
故答案为:>;
②反应后得到MCl溶液,水解呈酸性,则由质子守恒可知c(H+)=c(MOH)+c(OH-),则 c(H+)-c(MOH)=c(OH-)=1.0×10-8mol?L-1,
故答案为:1.0×10-8.
故答案为:>;
②反应后得到MCl溶液,水解呈酸性,则由质子守恒可知c(H+)=c(MOH)+c(OH-),则 c(H+)-c(MOH)=c(OH-)=1.0×10-8mol?L-1,
故答案为:1.0×10-8.
点评:本题考查酸碱混合的定性判断和计算,为高频考点,侧重于学生的分析能力和计算能力的考查,根据电荷守恒和质子守恒分析弱电解质的电离及盐类水解,题目难度不大.

练习册系列答案
相关题目
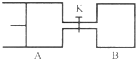 如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )
如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )| A、两容器中达到平衡的时间A<B |
| B、A容器中X的转化率为25%,且比B容器中X的转化率小 |
| C、打开K一段时间达到平衡时,A的体积为0.8aL(连通管中气体体积不计) |
| D、打开K达到新平衡后,升高B容器温度,A容器体积一定减小 |
某无色透明的酸性溶液中能大量共存的一组离子是( )
| A、Na+、SO42-、Al3+、Cl- |
| B、Na+、HCO3-、K+、SO42- |
| C、MnO4-、K+、SO42-、Na+ |
| D、Fe3+、Na+、SO42-、Cl- |
下列过程发生了化学反应的是( )
| A、用自来水制蒸馏水 |
| B、从海水中获得氯化钠 |
| C、煤的干馏 |
| D、石油的分馏 |
 金属镍及其化合物在能源、材料等工业中都有重要用途.
金属镍及其化合物在能源、材料等工业中都有重要用途. A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质.
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质.