题目内容
【化学--物质结构与性质】
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大.其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E的原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
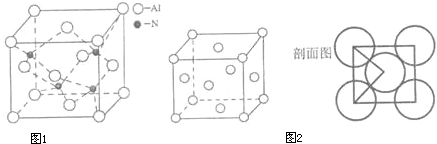
(1)E的核外电子排布式是 ,A、B、C、D的第一电离能由小到大的顺序为 ;
(2)B的氧化物的熔点远高于D的氧化物的熔点,理由是 ;
(3)A的最高价含氧酸根离子中,其中心原子是 杂化,D的低价氧化物分子的空间构型是 ;
(4)A、C形成某种化合物的晶胞结构如图1所示,则其化学式为 ;(每个球均表示1个原子)
(5)铜晶体的晶胞结构如图2,若铜原子的半径是rcm,则铜的密度的计算式是 (用NA表示阿伏伽德罗常数).
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大.其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E的原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)

(1)E的核外电子排布式是
(2)B的氧化物的熔点远高于D的氧化物的熔点,理由是
(3)A的最高价含氧酸根离子中,其中心原子是
(4)A、C形成某种化合物的晶胞结构如图1所示,则其化学式为
(5)铜晶体的晶胞结构如图2,若铜原子的半径是rcm,则铜的密度的计算式是
分析:C元素是地壳中含量最高的金属元素,所以C是Al元素;D原子核外的M层中有两对成对电子,电子排布式为1s22s22p63s23p4,所以D是S元素;E原子核外最外层只有1个电子,其余各层电子均充满,且E是前四周期的元素,其核外电子数目为2+8+18+1=29,所以Cu元素;A原子核外有三个未成对电子,且原子序数小于13,所以A是N元素,A与B可形成离子化合物B3A2,且B的原子序数大于A小于C,所以B是Mg元素.
解答:解:C元素是地壳中含量最高的金属元素,所以C是Al元素;D原子核外的M层中有两对成对电子,电子排布式为1s22s22p63s23p4,所以D是S元素;E原子核外最外层只有1个电子,其余各层电子均充满,且E是前四周期的元素,其核外电子数目为2+8+18+1=29,所以Cu元素;A原子核外有三个未成对电子,且原子序数小于13,所以A是N元素,A与B可形成离子化合物B3A2,且B的原子序数大于A小于C,所以B是Mg元素,
(1)E的原子序数是29,为Cu元素,其原子核外电子排布式为:1s22s22p63s23p63d104s1;Mg、Al、S元素是同一周期元素,同一周期元素的第一电离能逐渐增大,但镁的2s能级为全满稳定状态,其第一电离能大于铝的第一电离能,同一主族的第一电离能随着原子序数的增大而减小,所以N元素的第一电离能大于P元素,P元素第一电离能大于S元素,所以Mg、Al、S、N元素的第一电离能由小到大的顺序为Al<Mg<S<N,
故答案为:1s22s22p63s23p63d104s1;Al<Mg<S<N;
(2)氧化镁是离子晶体,SO2和SO3为分子晶体,离子晶体的熔点远大于分子晶体的熔点,
故答案为:MgO为离子晶体而SO2和SO3为分子晶体;
(3)NO3-中价层电子对=3+
(5+1-3×2)=3,所以N原子采取sp2杂化,D的低价氧化物是SO2,SO2的价层电子对=2+
(6-2×2)=3、含有一个孤电子对,所以分子空间构型是V型,
故答案为:sp2;V型;
(4)Al原子位于面心、顶点,N原子位于晶胞体内,该晶胞中Al原子数目=8×
+6×
=4,N原子数目=4,所以其化学式为AlN,
故答案为:AlN;
(5)Cu晶胞中Cu原子数目=8×
+6×
=4,晶胞质量=
g,铜原子的半径是rcm,则棱长=4r cm×
=2
r cm,则晶胞体积=(2
r cm)3,故晶体的密度=
=
g/cm3,
故答案为:
.
(1)E的原子序数是29,为Cu元素,其原子核外电子排布式为:1s22s22p63s23p63d104s1;Mg、Al、S元素是同一周期元素,同一周期元素的第一电离能逐渐增大,但镁的2s能级为全满稳定状态,其第一电离能大于铝的第一电离能,同一主族的第一电离能随着原子序数的增大而减小,所以N元素的第一电离能大于P元素,P元素第一电离能大于S元素,所以Mg、Al、S、N元素的第一电离能由小到大的顺序为Al<Mg<S<N,
故答案为:1s22s22p63s23p63d104s1;Al<Mg<S<N;
(2)氧化镁是离子晶体,SO2和SO3为分子晶体,离子晶体的熔点远大于分子晶体的熔点,
故答案为:MgO为离子晶体而SO2和SO3为分子晶体;
(3)NO3-中价层电子对=3+
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:sp2;V型;
(4)Al原子位于面心、顶点,N原子位于晶胞体内,该晶胞中Al原子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:AlN;
(5)Cu晶胞中Cu原子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 4×64 |
| NA |
| ||
| 2 |
| 2 |
| 2 |
| ||
(2
|
| 256 | ||
NA(2
|
故答案为:
| 256 | ||
NA(2
|
点评:本题以元素的推断为载体,考查了核外电子排布、分子空间构型、原子的杂化、晶胞计算等,注意第ⅡA和第ⅢA族、第ⅤA族和第ⅥA族之间第一电离能异常,注意根据均摊法进行晶胞计算.

练习册系列答案
相关题目

 (2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是 碳原子的杂化轨道类型为
碳原子的杂化轨道类型为 (2010?济南二模)【化学-物质结构与性质】
(2010?济南二模)【化学-物质结构与性质】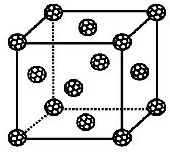 【化学-物质结构与性质】
【化学-物质结构与性质】