题目内容
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为
A.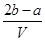 mol·L-1 B.
mol·L-1 B.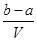 mol·L-1
mol·L-1
C.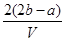 mol·L-1 D.
mol·L-1 D.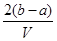 mol·L-1
mol·L-1
【答案】
C
【解析】
试题分析:设每份中镁离子的物质的量为x,硫酸根离子的物质的量为y,则由
Mg2++2OH-=Mg(OH)2↓可知,
1 2
x amol
解得x=0.5amol
由Ba2++SO42-=BaSO4↓可知
1 1
bmol y
解得y=bmol
忽略溶液中的H+和OH-由电荷守恒知
溶液中K+的物质的量为(b-0.5a)×2mol=(2b-a)mol
又由于混合溶液分成两等份,则原溶液中的K+的物质的量为2(2b-a)mol
则原混合溶液中钾离子的浓度为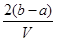 mol·L-1,所以答案选D。
mol·L-1,所以答案选D。
考点:考查溶液中根据方程式进行的离子浓度的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,基础性强,侧重对学生能力的培养。该题的关键是明确信息中恰好使离子转化为沉淀,然后利用离子之间的反应、电荷守恒、物质的量浓度的计算即可解答。

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为 ( )
A. mol·L-1 mol·L-1 | B. mol·L-1 mol·L-1 | C. mol·L-1 mol·L-1 | D. mol·L-1 mol·L-1 |
 mol·L-1
B.
mol·L-1
B. mol·L-1 C.
mol·L-1 C. mol·L-1 D.
mol·L-1 D. mol·L-1
mol·L-1 mol·L-1
B.
mol·L-1
B. mol·L-1
mol·L-1 mol·L-1
D.
mol·L-1
D. mol·L-1
mol·L-1