题目内容
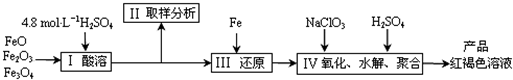
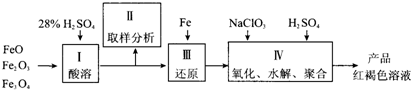
聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下: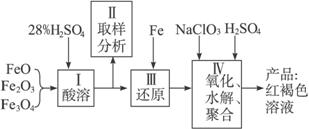
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有____________。
a.容量瓶 b.烧杯 c.烧瓶
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是____________。
a.控制溶液中Fe2+与Fe3+含量比
b.确定下一步还原所需铁的量
c.确定氧化Fe2+所需NaClO3的量
d.确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4====3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下:
6FeSO4+2HNO3+3H2SO4====3Fe2(SO4)3+2NO↑+4H2O
已知1 mol HNO3价格0.16元、1 mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊。利是_________________________,弊是_______________________________。
聚合硫酸铁溶液中![]() 与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中
与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中![]() 与Fe3+物质的量之比。
与Fe3+物质的量之比。
(4)测定时所需的试剂_____________。
a.NaOH b.FeSO4 c.BaCl2 d.NaClO3
(5)需要测定___________和___________的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作___________(按操作先后顺序列出)。
a.萃取、分液 b.过滤、洗涤 c.蒸发、结晶 d.冷却、称量
e.烘干或灼烧
解析:本题考查的是制备广泛用于水的处理的一种新型的无机高分子絮凝剂聚合硫酸铁(PFS)。考查了过滤、洗涤、冷却、称量、烘干或灼烧等基本操作;用98%浓H2SO4配制稀硫酸;测定某些物质的方法,考虑实验成本及对环境的影响等。分析如下:
(1)将98%的浓H2SO4稀释为28%的稀H2SO4,应将浓H2SO4沿玻璃棒注入盛水的烧杯中,不需要容量瓶和烧瓶。
(2)酸溶后溶液中含Fe3+、Fe2+,分析其中Fe3+、Fe2+的含量,便能确定还原Fe3+所需Fe的量及氧化Fe2+所需NaClO3的量。
(3)氧化6 mol FeSO4需要 2 mol HNO3或1 mol NaClO3,显然前者要便宜但它会产生污染性气体NO。
(4)—(6):用Ba2+沉淀![]() ,用OH-沉淀Fe3+后蒸干灼烧,通过测定BaSO4和Fe2O3的质量可确定n(
,用OH-沉淀Fe3+后蒸干灼烧,通过测定BaSO4和Fe2O3的质量可确定n(![]() ):n(Fe3+),其中涉及到沉淀的过滤、洗涤、烘干(BaSO4)和灼烧 [Fe(OH)3]及称量等操作,而与萃取、分液、蒸发、结晶等无关。
):n(Fe3+),其中涉及到沉淀的过滤、洗涤、烘干(BaSO4)和灼烧 [Fe(OH)3]及称量等操作,而与萃取、分液、蒸发、结晶等无关。
答案:(1)b
(2)b、c
(3)原料成本较低 产生气体对大气有污染
(4)a、c
(5)Fe2O3 BaSO4
(6)b、d、e


 要的用途。
要的用途。 ,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。
,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。 ____ 。
____ 。