题目内容
【题目】硫酰氯(SO2Cl2)熔点-54.1℃、沸点69.2℃,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。
(1)SO2Cl2中S的化合价为___________,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为__________。
(2)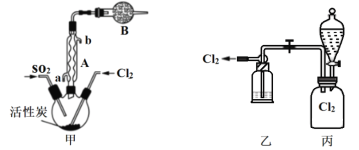
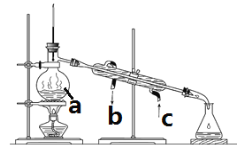
①仪器A的名称为___________,装置B的作用是____________。
②装置乙中装入的试剂是浓硫酸,装置丙分液漏斗中盛装的最佳试剂是________(选填字母)。
A.蒸馏水 B.10.0 molL1浓盐酸 C.浓氢氧化钠溶液 D.饱和食盐水
③滴定法测定硫酰氯的纯度:取1.800g产品,加入到100mL 0.5000mol·L1 NaOH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol·L1标准HCl滴定至终点,重复实验三次取平均值,消耗10.00mL滴定终点的判断为___________,产品的纯度为_________。
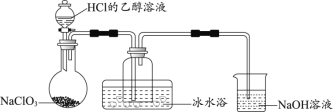
(3)探究硫酰氯在催化剂作用下加热分解的产物,实验装置如图所示(部分夹持装置未画出)。

①加热时A中试管出现黄绿色,装置B的作用是_________。
②装置C中反应的离子方程式为________。
【答案】+6 ![]() (球形)冷凝管 防止空气中的水蒸气进入三颈瓶,使SO2Cl2水解变质;吸收尾气 D 滴加最后一滴HCl标准液,锥形瓶内溶液由黄色变为橙色且30s内不变色 75.00% 吸收氯气
(球形)冷凝管 防止空气中的水蒸气进入三颈瓶,使SO2Cl2水解变质;吸收尾气 D 滴加最后一滴HCl标准液,锥形瓶内溶液由黄色变为橙色且30s内不变色 75.00% 吸收氯气 ![]()
【解析】
(1)SO2Cl2中O为-2价、Cl为-1价,则S的化合价为+6;SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为![]() ;
;
(2)①仪器A的名称为球形冷凝管;装置B的用处可从两个角度进行分析,一是防止空气内的水进入装置造成反应底物的污染,二是防止反应产物进入空气造成污染;
②氯气不溶于饱和食盐水,通过滴加饱和食盐水,将氯气排除,其他选项均不符合,故选D;
③硫酰氯在NaOH溶液中转化为NaCl和硫酸钠,用盐酸滴定过量的NaOH,甲基橙作指示剂,因此滴定终点的现象为滴加最后一滴HCl标准液,锥形瓶内溶液由黄色变为橙色且30s内不变色;发生的反应为![]() 和
和![]() ,因此
,因此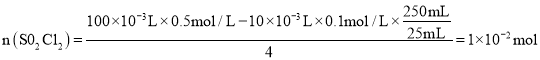 ,则
,则![]() ,故产品的纯度为1.35g÷1.800g×100%=75.00%;
,故产品的纯度为1.35g÷1.800g×100%=75.00%;
(3)硫酰氯分解生成了氯气,Cl的化合价升高,化合价降低的元素只能是S,从+6降到+4,生成二氧化硫。
①加热室A中出现黄绿色,说明生成了氯气,装置B的作用是吸收氯气;
②装置C中的现象是高锰酸钾溶液褪色,二氧化硫将其还原,离子方程式为![]() 。
。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务,回答有关问题:
(1)在一定条件下,2H2O==2H2↑+O2↑,下图能正确表示该反应中能量变化的是________(用A、B表示)。

从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:则生成1mol水热量变化为________kJ。
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
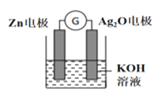
(2)在生产和生活中经常遇到化学能与电能的相互转化,银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意如图所示。在装置中Ag2O作_______极(填正或负)溶液中的K+向_____电极移动(填“Zn”或“Ag2O”);Ag2O电极发生______(还原或氧化反应),电极反应式为_____________________。
(3)一定温度下,将3molA气体和1molB气体通入一容积固定为1L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______;x为_________;此时反应物B的转化率为_________。若反应经2min达到平衡,平衡时C的浓度_____0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______;x为_________;此时反应物B的转化率为_________。若反应经2min达到平衡,平衡时C的浓度_____0.8mol/L(填“大于,小于或等于”)。