题目内容
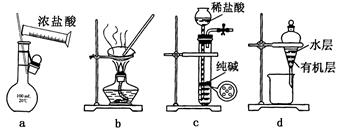
下列实验装置(固定装置略去)和操作正确的是


AD
试题分析:A、NO2与N2O4存在平衡关系2NO2
 N2O4 △H<0,该反应是放热反应,因此通过将装有NO2的烧瓶放在不同温度的水中,利用NO2颜色的变化可以证明温度对平衡的影响,A正确;B、氯化氢极易溶于水,吸收氯化氢时应该采用防倒吸装置,图中直接插入水中容易倒吸,B不正确;C、氢氧化亚铁极易被氧化生成氢氧化铁,因此将氢氧化钠溶液直接滴入氯化亚铁溶液中得不到氢氧化亚铁,C不正确;D、溴乙烷在氢氧化钠的乙醇溶液中发生消去反应生成乙烯,由于乙醇易挥发,生成的乙烯中含有乙醇。又因为乙醇也能使酸性高锰酸钾溶液褪色,所以通过水可以除去乙醇,防止干扰乙烯的检验,D正确,答案选AD。
N2O4 △H<0,该反应是放热反应,因此通过将装有NO2的烧瓶放在不同温度的水中,利用NO2颜色的变化可以证明温度对平衡的影响,A正确;B、氯化氢极易溶于水,吸收氯化氢时应该采用防倒吸装置,图中直接插入水中容易倒吸,B不正确;C、氢氧化亚铁极易被氧化生成氢氧化铁,因此将氢氧化钠溶液直接滴入氯化亚铁溶液中得不到氢氧化亚铁,C不正确;D、溴乙烷在氢氧化钠的乙醇溶液中发生消去反应生成乙烯,由于乙醇易挥发,生成的乙烯中含有乙醇。又因为乙醇也能使酸性高锰酸钾溶液褪色,所以通过水可以除去乙醇,防止干扰乙烯的检验,D正确,答案选AD。
练习册系列答案
相关题目







 Na2S2O3,
Na2S2O3,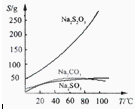
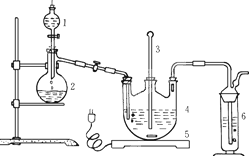
 6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,