题目内容
某温度下,0.1mol·L-1Na2CO3溶液中c(Na+)/c(CO32-)=20/9,其原因是________________.现往Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(CO32-)=5/2,其原因是______________.此时c(HCO3-)的物质的量浓度为________(体积变化忽略)
答案:
解析:
解析:
| CO32-,水解,c(CO32-)浓度减小;CO2与Na2CO3发生反应生成NaHCO3;0.04mol·L-1
|

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
某温度下,0.1mol?L-1NaHCO3溶液pH=10,下列判断正确的是( )
| A、c(H+)=10-10mol?L-1 | B、c(Na+)>c(OH-)>c(HCO3-)>c(H+) | C、c(Na+)+c(H+)=c(HCO3-)+c(OH-) | D、c(H2CO3)+c(H+)=c(CO32-)+c(OH-) |
某温度下,0.1mol·L-1NaHCO3溶液pH=10,下列判断正确的是( )
| A.溶液中碳酸氢根电离的氢离子浓度为10-10mol·L-1 |
B.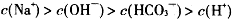 |
| C.溶液中水电离的氢氧根离子浓度为10-4mol·L-1 |
D.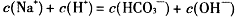 |