题目内容
【题目】某同学按图所示的装置实验,并把实验情况记录于下,其中叙述合理的是( )
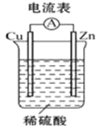
①锌为正极,铜为负极 ②电解质溶液的pH不变
③电流表的指针发生偏转 ④铜极上有气泡产生
⑤电子流动方向为Zn→Cu ⑥溶液中的阳离子向负极移动.
A.①②③ B.③④⑥ C.③④⑤ D.②③④
【答案】C
【解析】
试题分析:①锌比铜活泼,且锌和稀硫酸发生反应,因此锌作负极,铜作正极,故错误;②总电极反应式:Zn+2H+=Zn2++H2↑,消耗H+,c(H+)降低,pH增大,故错误;③因为构成原电池,有电子的通过,电流表指针发生偏转,故正确;④铜作正极,反应式为:2H++2e-=H2↑,故正确;⑤电子从负极经外电路流向正极,即从Zn→经外电路→Cu,故正确;⑥原电池的工作原理,阴离子向负极移动,阳离子向正极移动,故错误;综上所述,选项C正确。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目