题目内容
14.如图表示一些晶体中的某些结构,它们分别是NaCl、CaCl、干冰、金刚石、石墨结构中的某一种的某一部分.(1)其中代表金刚石的是(填编号字母,下同)D,其中每个碳原子与4碳原子最接近且距离相等.金刚石属于原子晶体.
(2)其中代表石墨的是E,其中每个正六边形占有碳原子数平均为2个.

(3)其中代表NaCl的是A,每个Na+周围与它最接近且距离相等的Na+有12个.
(4)代表CsCl的是C,它属于离子晶体,每个Cs+与8个Cl-紧邻.
(5)代表干冰的是B,它属于分子晶体,每个CO2分子与12个CO2分子紧邻.
(6)若说“离子晶体只有离子键,分子晶体中没有化学键”,是否正确?简述理由.
(7)NaCl晶体、HCl晶体、干冰、金刚石熔点由高而低的顺序是金刚石>NaCl>干冰>HCl晶体;其中在熔融为液态时能导电的电解质是NaCl晶体,液态不导电但为电解质的是HCl晶体.在水溶液中能导电的非电解质是干冰.
分析 (1)在金刚石晶胞中,每个碳可与周围四个碳原子形成共价键,将这四个碳原子连结起来后可以形成正四面体,体心有一个碳原子;由共价键结合形成的空间网状结构的晶体;
(2)石墨是层状结构,在层与层之间以范德华力相互作用,在层内碳与碳以共价键相互作用,形成六边形;
(3)在NaCl晶胞中,每个钠离子周围有六个氯离子,每个氯离子周围也有六个钠离子,根据晶胞的结构,每个钠离子周围距离最近的钠离子在小立方体的面对角线的位置,每个钠离子周围有八个这样的立方体,所以面对角线上的钠离子就有12个;
(4)CsCl的晶胞中铯离子和氯离子的配位数都是8,即每个铯离子周围有8个氯离子,每个氯离子周围也有8个铯离子;
(5)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上;
(6)由离子键构成的晶体为离子晶体;微粒间通过分子间作用力结合形成的晶体为分子晶体,分子内可能含有共价键;
(7)熔点的一般规律:原子晶体>离子晶体>分子晶体,晶体类型相同的,微粒间作用力越大,熔点越高;离子晶体在熔融时能导电;共价化合物在熔融时不导电.
解答 解:(1)在金刚石晶胞中,每个碳可与周围四个碳原子形成共价键,将这四个碳原子连结起来后可以形成正四面体,体心有一个碳原子,所以图E为金刚石,每个碳原子与四个碳原子最近且距离相等;金刚石晶体是由共价键结合形成的空间网状结构的晶体属于原子晶体;
故答案为:D;4;原子;
(2)石墨是层状结构,在层与层之间以范德华力相互作用,有分子晶体的特点,在层内碳与碳以共价键相互作用,形成六边形,所以图E为石墨的结构,为混合晶体,每个碳原子被三个六边形共用,所以每个正六边形占有碳原子数平均为6×$\frac{1}{3}$=2,
故答案为:E;2;
(3)在NaCl晶胞中,每个钠离子周围有六个氯离子,每个氯离子周围也有六个钠离子,所以图A为NaCl的结构,根据晶胞的结构,每个钠离子周围距离最近的钠离子在小立方体的面对角线的位置,每个钠离子周围有八个这样的立方体,形成12个面,所以面对角线上的钠离子就有12个,
故答案为:A;12;
(4)CsCl是由离子键形成的离子晶体,CsCl的晶胞中铯离子和氯离子的配位数都是8,即每个铯离子周围有8个氯离子,每个氯离子周围也有8个铯离子,所以图C为CsCl的结构;
故答案为:C;离子;8;
(5)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上,所以图B为干冰晶体,
故答案为:B;分子;12;
(6)由离子键构成的晶体为离子晶体,离子晶体中也可以有共价键,如NaOH晶体中含有共价键;微粒间通过分子间作用力结合形成的晶体为分子晶体,分子内可能含有共价键,如二氧化碳晶体中含有共价键,稀有气体晶体中没有共价键;
答:不正确,离子晶体中可能有共价键,分子晶体中也可能有共价键;
(7)熔点的一般规律:原子晶体>离子晶体>分子晶体,分子晶体的相对分子质量越大,微粒间作用力越大,熔点越高,则金刚石>NaCl>干冰>HCl晶体;离子晶体在熔融时能导电,NaCl晶体属于离子晶体在熔融时能够电离出钠离子和氯离子,能导电;HCl属于共价化合物,在熔融时不导电,在水溶液中能电离出氢离子和氯离子,在水中能导电属于电解质;二氧化碳属于共价化合物,在水中与水反应生成碳酸,本身不能发生电离,属于非电解质;
故答案为:金刚石>NaCl>干冰>HCl晶体;NaCl晶体;HCl晶体;干冰.
点评 本题考查了晶体类型的判断、化学键、熔点比较、电解质和非电解质等,难度中等,根据不同物质晶体的结构特点来辨别图形所代表的物质来解答即可,注意把握电解质与非电解质的概念.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |

| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②将铜丝向下移动使其与浓硝酸接触 | 产生红棕色气体,用排水法收集气体 | 可以用该装置制备NO2 |
| C | ③光照 | 试管颜色变浅,出现油状滴液,少量白雾 | 甲烷与氯水发生取代反应 |
| D | 打开分液漏斗 | 右侧试管中出现白色沉淀 | 酸性:HNO3>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
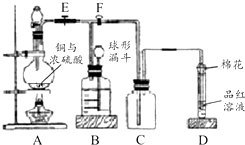 某课外兴趣小组为探究铜跟浓硫酸反应情况,用如图所示装置进行实验.
某课外兴趣小组为探究铜跟浓硫酸反应情况,用如图所示装置进行实验. 某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:
某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题: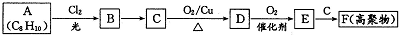
 ;E一→F反应类型为缩聚反应.
;E一→F反应类型为缩聚反应. .
. .
.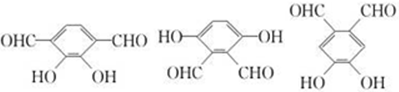 (2种即可).
(2种即可).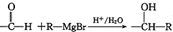 现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J(
现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J( ),则
),则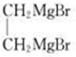 ,
,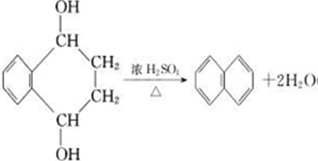 .
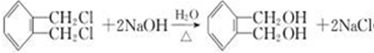
.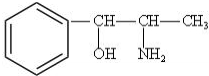 构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知:
构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知: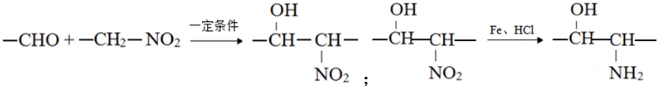
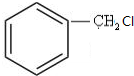 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$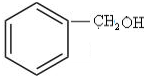 +NaCl.
+NaCl.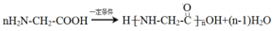 .
.