题目内容
请根据要求作答:
(1)按要求写出相关反应的离子方程式:
a.向亚硫酸氢铵溶液中滴加过量的氢氧化钠溶液 ;
b.向溴化亚铁溶液中通入过量的氯气 。
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为 ;
又已知H2O(g)=H2O(l);△H=-44 kJ?mol-1,则0.5 mol乙硼烷完全燃烧生成气态水时放出的热量
是 kJ。
(3)已知在0.1 mol?L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序为:
c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)
则该溶液中,c(H+) c(OH-)(填“>”、“<”或“=”),简述理由并写出相关的方程式?
。
(1)a:NH4+HSO3-+2OH-=NH3?H2O+SO32-+H2O
b:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
(2)B2H6(g)+3O2(g)=B2O3(s)+3H2O(l);△H=-2165 kJ?mol-1 1016.5
(3)>,亚硫酸氢钠溶液中,存在HSO3-的电离平衡:HSO3-![]() H++SO32-;还有HSO3-的水解平衡:HSO3-+H2O
H++SO32-;还有HSO3-的水解平衡:HSO3-+H2O![]() H2SO3+OH-。由题给信息c(SO32-)>c(H2SO3)可得出,上述电离程度比水解程度强,故c(H+)>c(OH-)。
H2SO3+OH-。由题给信息c(SO32-)>c(H2SO3)可得出,上述电离程度比水解程度强,故c(H+)>c(OH-)。

练习册系列答案
相关题目

 +CH3CH2OH
+CH3CH2OH +H2O
+H2O
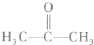
 生成C7H5O3Na的化学反应方程式.
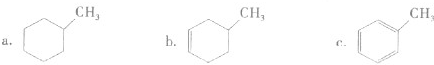
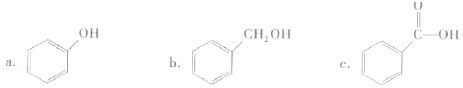
生成C7H5O3Na的化学反应方程式. 所有同分异构体的结构简式
所有同分异构体的结构简式 、
、