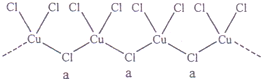
题目内容
|
阿伏加德罗常数为6.02×1023mol-1,下列叙述中正确的是 | |
A. |
常温条件下,18.0 g重水(D2O)所含的电子数为10×6.02×1023 |
B. |
室温下,42.0 g乙烯(CH2=CH2)和丙烯(CH3CH=CH2)的混合气体中含有的碳原子数为3×6.02×1023 |
C. |
标准状况下,22.4 L苯(一种液体)所含的分子数为6.02×1023 |
D. |
标准状况下,a L甲烷(CH4)和乙烷(C2H6)混合气体中的分子数为 |
答案:BD
解析:
提示:
解析:
|
误区突破:标况下气体的摩尔体积Vm=22.4 L/mol,仅适用于标准状况下的气体,对液体、固体不适用. |
提示:
|
有关阿伏加德罗常数的考查是历年高考的热点题型之一,主要考查考生对该常数的理解和应用. |

练习册系列答案
相关题目