题目内容
(16分)
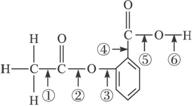
某有机物A在酸性溶液中加热可发生如下反应:

请回答下列问题:
(1)下列关于该有机物A说法错误的是 。
①可发生银镜反应 ②1molA在一定条件下与氢气反应,最多可消耗5molH2
③能发生消去反应 ④1molA与烧碱溶液反应,最多可消耗4mol NaOH
(2)有机物B的化学式(分子式)为 ;B在铂的催化下,与足量氢气发生加
成反应生成X,则X的结构简式为 。
(3)有机物R的结构简式为 ; R与足量的醋酸发生 反应(填基本反应类型)的化学方程式为:
。
(16分)
(1)(4分)②④
(2)(3分)C11H12O4 (2分)
(3)(2分) 或
或  (2分)酯化(或取代)反应
(2分)酯化(或取代)反应
(3分) 
【解析】略

(28分)
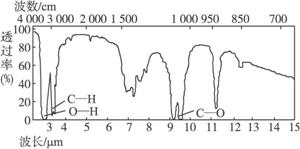
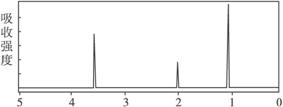
[1]由碳、氢、氧三种元素组成的某有机物分子中共含有13个原子,其原子核外共有40个电子,l mol该有机物在氧气中完全燃烧时需消耗5.5 mol O2。请回答:
(1)试求出该有机物的分子式为 。
(2)若该有机物可使溴水褪色,且分子中不含有甲基,也不能发生银镜反应,取0.1 mol该有机物与足量钠反应,能产生1.12 L H2(标准状况),则该有机物的结构简式可能是 ;该有机物在一定条件下发生聚合反应的化学方程式是 。
(3)若该有机物能发生银镜反应,且分子中只含有一个甲基,则其结构简式是 。
(4)若该有机物的结构呈环状,且既不含甲基又不含羟基,则其键线式是 。
|
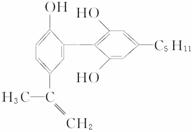
溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强
的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为 。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其属于醇类的同分异构体的结构简式 。
(3)下列有关“亮菌甲素”的叙述正确的是 (填序号)。
A.“亮菌甲素”能与H2发生加成反应 B.不能使酸性KMnO4退色
C.“亮菌甲素”分子中含氧官能团只有2种 D.1mol“亮菌甲素”最多与2molNaOH反应
(4)核磁共振氢谱分析,发现二甘醇分子中有3个肿收峰,其峰面积之比为2:2:1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1mol二甘醇与足量的金属钠反应生成1molH2。写出二甘醇与乙酸(按物质的量之比1:1)反应的化学方程式
铜、铜的氧化物及铜的氢氧化物都是常用的化学试剂。已知红色的氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,Cu2O在空气中灼烧生成CuO。含有醛基的有机物与新制的氢氧化铜共热会出现Cu2O红色沉淀,某化学兴趣小组对此提出质疑,认为红色沉淀还可能是Cu2O和Cu的混合物,为了验证上述猜测,他们设计了如下三个方案:
| 方案甲 | 取该红色沉淀溶于稀硫酸中,观察是否有残渣。 |
| 方案乙 | 取该红色沉淀溶于稀硝酸中,观察溶液颜色。 |
| 方案丙 | 称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称重,反复多次直到固体恒重称的固体质量为b g,比较a和b的关系。 |
(2)上述三个方案中,你认为最合理的是 ,实施该实验方案能说明红色沉淀仅是Cu2O的依据是 ;
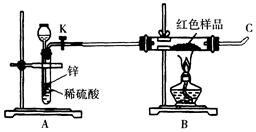
(3)小林同学针对上述质疑,提出新的试验方案并组装出下列实验装置,根据实验前后红色样品质量比较验证上述猜测。进行该实验时,称量装有红色样品的双通管并连接各仪器之后,点燃酒精灯前,应进行的实验操作是 。
(28分)
[1]由碳、氢、氧三种元素组成的某有机物分子中共含有13个原子,其原子核外共有40个电子,l mol该有机物在氧气中完全燃烧时需消耗5.5 mol O2。请回答:
(1)试求出该有机物的分子式为 。
(2)若该有机物可使溴水褪色,且分子中不含有甲基,也不能发生银镜反应,取0.1 m ol该有机物与足量钠反应,能产生1.12 L H2(标准状况),则该有机物的结构简式可能是 ;该有机物在一定条件下发生聚合反应的化学方程式是 。
ol该有机物与足量钠反应,能产生1.12 L H2(标准状况),则该有机物的结构简式可能是 ;该有机物在一定条件下发生聚合反应的化学方程式是 。
(3)若该有机物能发生银镜反应,且分子中只含有一个甲基,则其结构简式是 。
(4)若该有机物的结构呈环状,且既不含甲基又不含羟基,则其键线式是 。
|
|
溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强
的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为 。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其属于醇类的同分异构体的结构简式 。
(3)下列有关“亮菌甲素”的叙述正确的是 (填序号)。
A.“亮菌甲素”能与H2发生加成反应 B.不能使酸性KMnO4退色
C.“亮菌甲素”分子中含氧官能团只有2种 D.1mol“亮菌甲素”最多与2molNaOH反应
(4)核磁共振氢谱分析,发现二甘醇分子中有3个肿收峰,其峰面积之比为2:2:1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1mol二甘醇与足量的金属钠反应生成1molH2。写出二甘醇与乙酸(按物质的量之比1:1)反应的化学方程式

铜、铜的氧化物及铜的氢氧化物都是常用的化学试剂。已知红色的氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,Cu2O在空气中灼烧生成CuO。含有醛基的有机物与新制的氢氧化铜共热会出现Cu2O红色沉淀,某化学兴趣小组对此提出质疑,认为红色沉淀还可能是Cu2O和Cu的混合物,为了验证上述猜测,他们设计了如下三个方案:
|
方案甲 |
取该红色沉淀溶于稀硫酸中,观察是否有残渣。 |
|
方案乙 |
取该红色沉淀溶于稀硝酸中,观察溶液颜色。 |
|
方案丙 |
称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称重,反复多次直到固体恒重称的固体质量为b g,比较a和b的关系。 |
(1)如果红色沉淀是Cu2O和Cu的混合物,按上述方案乙进行实验,写出可能发生反应的化学方程式 ;
(2)上述三个方案中,你认为最合理的是 ,实施该实验方案能说明红色沉淀仅是Cu2O的依据是 ;
(3)小林同学针对上述质疑,提出新的试验方案并组装出下列实验装置,根据实验前后红色样品质量比较验证上述猜测。进行该实验时,称量装有红色样品的双通管并连接各仪器之后,点燃酒精灯前,应进行的实验操作是 。
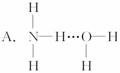
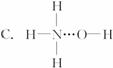
 的沸点高于
的沸点高于