题目内容
2.写出在水溶液中下列各物质的方程式:KHSO4电离:KHSO4=K++H++SO42-
NaHCO3的电离:NaHCO3═Na++HCO3-
CH3COOH电离:CH3COOH?CH3COO-+H+
NH3•H2O电离:NH3•H2O?NH4++OH-
Na2CO3水解:Na2CO3+H2O?NaOH+NaHCO3、NaHCO3+H2O?NaOH+H2CO3
NH4Cl水解:NH4Cl+H2O?NH3•H2O+HCl.
分析 KHSO4是强电解质,KHSO4在水中电离出钾离子和硫酸根离子和氢离子;
碳酸氢钠属于强电解质,完全电离出钠离子和碳酸氢根离子;
CH3COOH为弱电解质,部分电离,用可逆符号;
H2CO3为二元弱酸,Na2CO3水解分步进行;
NH3•H2O为弱电解质,氯化铵水解.
解答 解:KHSO4是强酸强碱酸式盐,属强电解质,完全电离,电离出K+、H+、SO42-离子,电离方程式为:KHSO4=K++H++SO42-,
故答案为:KHSO4=K++H++SO42-;
碳酸氢钠属于强电解质,溶液中完全电离,碳酸为弱酸,碳酸氢根离子不能拆写,碳酸氢钠的电离方程式为:NaHCO3═Na++HCO3-,
故答案为:NaHCO3═Na++HCO3-;
醋酸为弱电解质,部分电离,电离方程式:CH3COOH?CH3COO-+H+,
故答案为:CH3COOH?CH3COO-+H+;
NH3•H2O为弱电解质,电离方程式为NH3•H2O?NH4++OH-,
故答案为:NH3•H2O?NH4++OH-;
碳酸根离子为多元弱酸的酸根离子,水解分步进行,所以Na2CO3水解为:Na2CO3+H2O?NaOH+NaHCO3、NaHCO3+H2O?NaOH+H2CO3,
故答案为:Na2CO3+H2O?NaOH+NaHCO3、NaHCO3+H2O?NaOH+H2CO3;
铵根离子在溶液中水解生成一水合氨和氢离子,所以NH4Cl水解方程式为:NH4Cl+H2O?NH3•H2O+HCl,
故答案为:NH4Cl+H2O?NH3•H2O+HCl.
点评 本题考查电离方程式和水解离子方程式,明确电解质的强弱及常见的酸根离子,并利用电荷守恒是解答关键,注意电解质的强弱的判断及多元弱酸根离子水解分步完成,多元弱碱离子的水解一步完成,题目难度不大.

-CH3+2KMnO4$\stackrel{△}{→}$-COOK+KOH+2MnO2↓+H2O
-COOK+HCl→-COOH+KCl
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是溶液颜色褪去.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中, 加热溶解,冷却结晶、过滤 | 得到白色晶体和无色溶液 | 无 |
| ② | 取少量滤液于试管中, 滴入稀HNO3和AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,测定熔点 | 白色晶体在122.4℃左右完全熔化 | 白色晶体是苯甲酸 |
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
(1)该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(S{O}_{2})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$.
(2)在3min-4min及7min-9min时间段,反应处于平衡状态.
(3)计算:0~3min时间内,用SO2表示该反应的平均反应速率是0.08mol/min,7min时,SO2的转化率为30%.
(4)第5min时,从速率和转化率两个方面分析,改变的外界条件是增大压强;平衡向正反应方向移动.
(5)在101Kpa、500℃时,O2的物质的量与SO2平衡时的体积百分含量的变化曲线如图1:
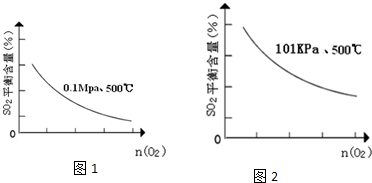
在图中2画出在相同压强下,温度为400℃时,起始O2的物质的量与SO2平衡时的体积百分含量的大致变化曲线.
| A. | 用NaOH溶液滴定盐酸,滴定前尖嘴下端有气泡,滴定后气泡消失,会使结果偏高 | |
| B. | 仰视量筒刻度量取一定量浓硫酸所配制的0.10 mol•L-1 H2SO4溶液的浓度结果偏低 | |
| C. | 焰色反应实验中,铂丝在蘸取待测溶液前应先用稀硫酸洗净并灼烧至无色 | |
| D. | 要将溶解在CCl4中的碘分离出来,以用蒸馏法,因为碘易升华,先分离出来 |
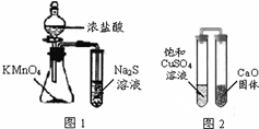
| A. | 下列有关实验原理、操作或现象不正确的是图1锥形瓶中滴入浓盐酸后充满黄绿色气体,试管中出现浅黄色浑浊 | |
| B. | 图2放置一段时间后,饱和CuSO4溶液中出现白色晶体 | |
| C. | 用玻璃棒蘸取某溶液做焰色反应实验,火焰呈黄色说明该溶液中不含钾元素 | |
| D. | 蒸馏时,将温度计水银球靠近蒸馏烧瓶支管口处 |
| A. | SO3 | B. | CaO | C. | SO2 | D. | CO |
