题目内容
5.为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1mol XY2含有54mol电子.(1)该融雪剂的化学式是CaCl2,该物质中化学键类型是离子键,电子式是
 .
.(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是
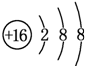 ;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为S=C=S,电子式为
;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为S=C=S,电子式为 ,化学键类型为极性共价键(填“离子键”、“非极性共价键”或“极性共价键”).
,化学键类型为极性共价键(填“离子键”、“非极性共价键”或“极性共价键”).(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成Na2O,其化学键类型为离子键;加热时生成Na2O2,其化学键类型为离子键和非极性共价键.
分析 (1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为$\frac{54}{3}$=18,则为Ca2+、Cl-,故XY2是CaCl2;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素;E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的类似于CO2的三原子分子为CS2,与二氧化碳结构类似,属于共价化合物;
(3)W是与S同主族的短周期元素,则W为O元素,Z是第三周期金属性最强的元素,则Z为Na,钠与氧气反应,不加热生成Na2O,加热生成Na2O2.
解答 解:(1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为$\frac{54}{3}$=18,则为Ca2+、Cl-,故XY2是CaCl2,含有离子键,其电子式为 ,
,
故答案为:CaCl2;离子键; ;
;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素,S2-离子结构示意图是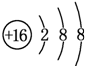 ;
;
E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的类似于CO2的三原子分子为CS2,与二氧化碳结构类似,其结构式为:S=C=S,电子式为 ,含有极性共价键;
,含有极性共价键;
故答案为: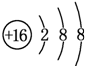 ;S=C=S;
;S=C=S; ;极性共价键;
;极性共价键;
(3)W是与S同主族的短周期元素,则W为O元素,Z是第三周期金属性最强的元素,则Z为Na,钠与氧气反应,不加热生成Na2O,含有离子键,加热生成Na2O2,含有离子键和非极性共价键,
故答案为:Na2O,离子键;Na2O2,离子键和非极性共价键.
点评 本题考查结构性质位置关系、常用化学用语、物质结构与性质等,难度不大,注意对基础知识的理解掌握.

 互动英语系列答案
互动英语系列答案| A. | 在某淀粉溶液中加入适量的稀硫酸,并加热一段时间,待冷却后,再加入银氨溶液来检验淀粉是否已发生水解 | |
| B. | 把R-X与NaOH水溶液混合,加入硝酸银溶液来验证R-X是否为碘代烷 | |
| C. | 在三颈烧瓶中先加入少量铁粉,再加入5mL苯和1mL液溴的混合物,待充分反应后可制得少量溴苯 | |
| D. | 将无水乙醇和浓硫酸共热至140℃可制得乙烯 |
| A. | 乙酸的最简式:CH2O | B. | Cl-的结构示意图: | ||
| C. | 甲醛的电子式: | D. | 对硝基甲苯的结构简式: |
| A. | 两烧杯中的沉淀可能一样多 | |
| B. | 两烧杯中沉淀的最大可能值均为0.078g | |
| C. | 反应后两烧杯中溶液的pH可能:甲<乙 | |
| D. | 两烧杯中反应的离子方程式不同 |
 下列各组物质中,能一步实现右图所示①~⑤转化关系的是( )
下列各组物质中,能一步实现右图所示①~⑤转化关系的是( )| X | Y | Z | W | |
| A | Fe3O4 | Fe | FeCl2 | FeCl3 |
| B | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| C | H2SO4 | SO2 | S | SO3 |
| D | Si | SiO2 | Na2SiO3 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定没有甲烷 | D. | 可能含有乙烷 |
| A. | Na与水反应时增大水的用量 | |
| B. | Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| D. | 将炭块磨成炭粉用于燃烧 |
 ,最高价氧化物的化学式为:Cl2O7.
,最高价氧化物的化学式为:Cl2O7. .
. .
.


