题目内容
工业制取盐酸的方法是:将H2与Cl2反应,生成的HCl用水吸收即得盐酸。试回答有关问题:
(1)工业制得的盐酸为何显黄色(即如何混入了Fe3+)?
(2)有两种制得HCl的方案:a.H2在Cl2中燃烧 b.Cl2在H2中燃烧
试分析工业实际采用的方案是选择了________(填序号),理由是______________________
________________________________。
答案:
解析:
解析:
解析:(1)因输送Cl2的管道是钢管,在有少量水分存在时Cl2将Fe氧化成FeCl3,少量的FeCl3随着Cl2带入生成的HCl中。 (2)b 因Cl2有毒,对环境污染较大,H2在Cl2中燃烧,必然是H2在管口,Cl2是环境,而Cl2易散逸造成污染,此方法的关键是设法在H2中点燃Cl2,即方案b。 答案:略
|

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
某兴趣小组设计并进行了以下实验来探究Cl2、漂白粉的制备及有关性质.
(1)实验室拟用如图装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→ 、 → 、 → ;广口瓶Ⅱ中的试剂为 .
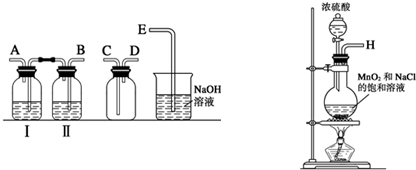
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式: ;
(3)某学生设计如表实验进一步探究SO2与漂粉精的反应,则漂白粉具有 :
(4)该同学推测现象i的雾状物由盐酸小液滴形成,进行如下实验加以进一步验证:
a.用湿润的碘化钾淀粉试纸检验雾状物,无变化;
b.搜集雾状物,用酸化的AgNO3溶液检验,产生白色沉淀.
实验a的目的是 .
(5)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的某些成份之间发生反应.请设计实验方案,进一步确认这种可能性,方案为 .
(6)用化学方程式解释现象ⅲ中黄绿色褪去的原因 .检验褪色后溶液中是否有Cl-的方法是: .
(1)实验室拟用如图装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→

(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:
(3)某学生设计如表实验进一步探究SO2与漂粉精的反应,则漂白粉具有
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
 |
ⅰ.液面上方出现雾状物 ⅱ.稍后,出现浑浊,溶液变为黄绿色 ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
a.用湿润的碘化钾淀粉试纸检验雾状物,无变化;
b.搜集雾状物,用酸化的AgNO3溶液检验,产生白色沉淀.
实验a的目的是
(5)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的某些成份之间发生反应.请设计实验方案,进一步确认这种可能性,方案为
(6)用化学方程式解释现象ⅲ中黄绿色褪去的原因
 (2010?绵阳模拟)工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体.该反应原理可以用以下化学方程式表示,此反应是放热反应.NH3+CO2+H2O+NaCl (饱和)═NaHCO3(晶体)+NH4Cl
(2010?绵阳模拟)工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体.该反应原理可以用以下化学方程式表示,此反应是放热反应.NH3+CO2+H2O+NaCl (饱和)═NaHCO3(晶体)+NH4Cl