题目内容
为了除去FeCl2溶液中混有的少量FeCl3,最好的方法是向此溶液中
| A.通入氯气 | B.加入Zn | C.加入Fe | D.加入Cu |
C
解析试题分析:在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。A、氯气能和氯化亚铁反应生成氯化铁,A不正确;B、锌是活泼的金属,能和氯化铁、氯化亚铁反应置换出铁,B不正确;C、氯化铁能和铁反应生成氯化亚铁,C正确;D、氯化铁能和铜反应生成氯化亚铁和氯化铜,引入了新的杂质,D不正确,答案选C。
考点:考查物质的除杂

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
下列有关金属及其化合物的说法中正确的是
| A.铝和氢氧化钠溶液反应生成Al(OH)3和H2O |
B.钠在空气中燃烧生成淡黄色的 |
| C.铁在高温下与水蒸气反应生成Fe2O3和H2 |
| D.用碳酸钠和氢氧化钙反应制NaOH |
在FeCl2和AlCl3的混合溶液中加入过量的氨水,直至溶液中沉淀的量不再改变为止。经过滤、洗涤、干燥、在空气中灼烧,最终剩余固体的成分是 ( )
| A.Fe2O3、Al2O3 | B.Fe2O3 |
| C.Fe (OH)2、Al(OH)3 | D.Fe(OH)3、Al(OH)3 |
工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl=CuCl2+H2O
FeO+2HCl=FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是 ( )
| A.直接加碱,调整溶液pH≥9.6 |
| B.加纯铜粉,将Fe2+还原出来 |
| C.先将Fe2+氧化成Fe3+,再调整pH在3~4 |
| D.通入硫化氢,使Fe2+直接沉淀 |
将2.3 g金属钠放入100 g水中,完全反应后溶质的质量分数为( )
A.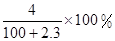 | B.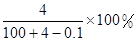 |
C.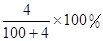 | D.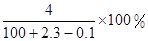 |


 ”是“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
”是“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是