题目内容
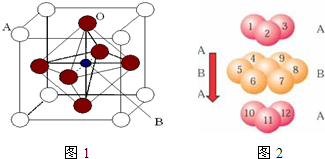
已知Fe x O晶体的晶胞结构为NaCl型,由于晶体缺陷,x的值小于1。测知Fe x O晶体密度ρ为5.71g?cm3,晶胞边长为4.28×1010m(铁原子量为55.9,氧原子量为16.0)。求:
(1)FexO中x的值(精确至0.01)。
(2)晶体中的Fe分别为Fe2+ 和Fe3+,在Fe2+ 和Fe3+ 的总数中,Fe2+ 所占分数为多少?(精确至0.001。)
(3)写出此晶体的化学式。
(4)描述Fe在此晶体中占据空隙的几何形状(即与O2 距离最近且等距离的铁离子围成的空间形状)。
(5)在晶体中,铁元素的离子间最短距离为多少?
(1)0.92
(2)0.826
(3)Fe2+0.76Fe3+0.16
(4)正八面体
(5)3.03×1010 m
提示:(1)由NaCl晶胞结构可知,1mol NaCl晶胞中含有4 mol NaCl,故在Fe x O晶体中1mol Fe x O晶胞中含有4 mol Fe x O。设Fe x O的摩尔质量为M g?mol1,晶胞的体积为V。则有:4M = ρVN0,代入数据解得M = 67.4 g?mol1, 则x = 0.92。
(2)设Fe2+ 为y个,Fe3+ 则为(0.92-y)个,由正负化合价代数和为零可得:
2y + 3(0.92-y)= 2,则y = 0.76
(3)由于Fe2+ 为0.76,则Fe3+ 为(0.92-0.76)= 0.16,故化学式为Fe2+0.76Fe3+0.16
(4)与O2 距离最近且等距离的铁离子有6个, 这6个铁离子所围成的几何形状如图所示:

由图可知Fe在晶体中占据空隙的几何形状为正八面体。
(5)晶体中Fe―Fe最短距离r =![]() ×晶胞边长 = .03×1010 m。
×晶胞边长 = .03×1010 m。

练习册系列答案
相关题目