题目内容
室温时,向a mL 0.10mol/L的稀氨水中逐滴加入 b mL 0.10mol/L的稀盐酸,试分析:
(1)当b=a时,溶液呈
)
(2)当溶液呈中性时,a
)
(1)当b=a时,溶液呈
酸
酸
(填“酸”“碱”或“中”)性,此时溶液中,c(| NH | + 4 |
<
<
(填“>”“<”或“=”)c(Cl-).(2)当溶液呈中性时,a
>
>
(填“>”“<”或“=”)b,此时溶液中c(| NH | + 4 |
=
=
c(Cl-)(同上).分析:(1)当a=b时,氨水和稀盐酸的物质的量相等,二者恰好反应生成氯化铵,根据氯化铵的性质确定溶液的酸碱性;
(2)氯化铵是强酸弱碱盐,其溶液呈酸性,要使氯化铵溶液呈中性,则氨水的物质的量应该稍微大些,根据电荷守恒判断.
(2)氯化铵是强酸弱碱盐,其溶液呈酸性,要使氯化铵溶液呈中性,则氨水的物质的量应该稍微大些,根据电荷守恒判断.
解答:解:(1)当a=b时,氨水和稀盐酸的物质的量相等,二者恰好反应生成氯化铵,氯化铵是强酸弱碱盐,其溶液呈酸性,铵根离子易水解,氯离子不水解,所以铵根离子浓度小于氯离子浓度,
故答案为:酸;<;
(2)氯化铵是强酸弱碱盐,其溶液呈酸性,要使氯化铵溶液呈中性,则氨水的物质的量应该稍微大些,所以氨水的体积稍微大些,溶液呈中性,则溶液中氢离子浓度等于氢氧根离子浓度,根据电荷守恒知,c(NH4+)=c(Cl-),
故答案为:>;=.
故答案为:酸;<;
(2)氯化铵是强酸弱碱盐,其溶液呈酸性,要使氯化铵溶液呈中性,则氨水的物质的量应该稍微大些,所以氨水的体积稍微大些,溶液呈中性,则溶液中氢离子浓度等于氢氧根离子浓度,根据电荷守恒知,c(NH4+)=c(Cl-),
故答案为:>;=.
点评:本题考查了酸碱混合溶液离子浓度大小的判断,根据盐的性质、电荷守恒和物料守恒来分析解答,难度中等.

练习册系列答案
相关题目

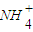 )______(填“>”“<”或“=”)c(Cl-).
)______(填“>”“<”或“=”)c(Cl-).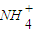 )______c(Cl-)(同上).
)______c(Cl-)(同上).