题目内容
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。T1℃时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P1。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是( )
CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P1。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是( )
| A.曲线II对应的条件改变是增大压强 |
| B.T2℃时,上述反应平衡常数为0.42,则T2>T1 |
| C.在T1℃,若起始时向容器中充入 5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆) |
D.在T1℃,若起始时向容器中充入4.5molCO2、6mol H2 ,平衡时容器内压强p= |
D
解析试题分析: A项,对于CO2(g)+3H2(g) CH3OH(g)+H2O(g),增大压强,化学平衡向正向移动,CH3OH的物质的量增大,且反应速率加快,达到平衡所需的时间短,故A正确。
CH3OH(g)+H2O(g),增大压强,化学平衡向正向移动,CH3OH的物质的量增大,且反应速率加快,达到平衡所需的时间短,故A正确。
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始浓度(mol·L-1) 3 4 0 0
转化浓度(mol·L-1) 1 3 1 1
平衡浓度(mol·L-1) 2 1 1 1
T1时化学平衡常数K= =
= =0.5>0.42,而该反应ΔH<0,则T2>T1。B项正确。
=0.5>0.42,而该反应ΔH<0,则T2>T1。B项正确。
选项C,Qc= =0.36<0.5,故反应正向进进行,v(正)>v(逆),正确。D项,起始时向容器中充入4.5molCO2、6mol H2 ,均为原起始状态的一半,相当于减小压强,原平衡向逆向移动,则新平衡时容器内压强p>
=0.36<0.5,故反应正向进进行,v(正)>v(逆),正确。D项,起始时向容器中充入4.5molCO2、6mol H2 ,均为原起始状态的一半,相当于减小压强,原平衡向逆向移动,则新平衡时容器内压强p> 。
。
考点:化学平衡状态

T1℃时,向容积为2 L的密闭容器中充入一定量的A气体和B气体,发生如下反应:
A(g)+2B(g) C(g)
C(g)
反应过程中测定的部分数据见下表:
| 反应时间/min | n(A)/mol | n(B)/ mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | | 0.20 |
下列说法正确的是
A.前10 min内反应的平均速率为v(C)=0.050 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)<0.25 mol
C.若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动
D.温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
可逆反应① 、②
、②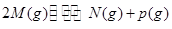 分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
下列判断正确的是:
| A.反应①的正反应是吸热反应 |
| B.在平衡(I)和平衡(II)中的气体摩尔体积相同 |
| C.达平衡(I)时X的体积分数为5/11 |
| D.达平衡(I)时体系的压强与反应开始时体系的压强之比为10:11 |
在一定条件下,向一带活塞的密闭容器中充入2mol NO2,发生下列反应2NO2(g)  N2O4(g) ΔH < 0,达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图。下列对t1时刻改变条件的推测中正确的是
N2O4(g) ΔH < 0,达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图。下列对t1时刻改变条件的推测中正确的是
| A.保持压强不变,升高反应温度 |
| B.保持温度和容器体积不变,充入1mol N2(g) |
| C.保持温度和容器体积不变,充入1mol N2O4(g) |
| D.保持温度和压强不变,充入1mol N2O4(g |
可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化表示。下列各关系中能说明反应已达到平衡状态的是
| A.3υ正 (N2)=υ正 (H2) | B.υ正 (N2)=υ逆 (NH3) |
| C.2υ正 (H2)=3υ逆 (NH3) | D.υ正 (N2)=3υ逆 (H2) |
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两实验:(N2O4 2NO2 ΔH>0)
2NO2 ΔH>0)
(a)将两容器置于沸水中加热(b)在活塞上都加2 kg的砝码
(b)在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
| A.(a)甲>乙,(b)甲>乙 | B.(a)甲>乙,(b)甲=乙 |
| C.(a)甲<乙,(b)甲>乙 | D.(a)甲>乙,(b)甲<乙 |
关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛其化学机理为:
① HUr + H2O  Ur- + H3O+ ②Ur- (aq)+Na+(aq)
Ur- + H3O+ ②Ur- (aq)+Na+(aq)  NaUr(s)
NaUr(s)
(尿酸) (尿酸根离子)
下列对反应②叙述中正确的是( )
| A.反应的△H>0 | B.反应的△H<0 |
| C.升高温度平衡向正反应方向移动 | D.改变温度不影响平衡移动 |
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:①Sn(s,白)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH1
②Sn(s,灰)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH2
③Sn(s,灰) 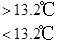 Sn(s,白) ΔH3=+2.1 kJ·mol-1
Sn(s,白) ΔH3=+2.1 kJ·mol-1
下列说法正确的是 ( )
| A.ΔH1>ΔH2 |
| B.锡在常温下以灰锡状态存在 |
| C.灰锡转化为白锡的反应是放热反应 |
| D.锡制器皿长期处在低于13.2 ℃的环境中,会自行毁坏 |
 xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是( )
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是( )