题目内容
等量的Na、Mg、Al三种金属与含有1mol H+的盐酸分别反应时,产生的H2的体积可能会出现下列四种情况:①V(Na)>V(Mg)=V(Al) ②V(Na)=V(Mg)=V(Al)
③V(Mg)=V(Al)>V(Na) ④V(Al)>V(Mg)>V(Na)
试确定满足上述四种情况时金属的物质的量x的取值范围.
答案:
解析:
解析:
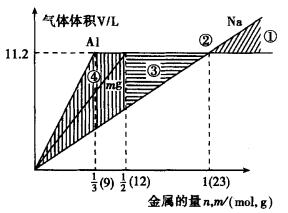
| 解析:已知n(H+)=1mol,当H+恰好完全反应时,消耗的Na、Mg、Al的物质的量分别为1mol, 在同一直角坐标系中画出Na、Mg、Al所对应的V(H2)与金属的量的图象.如图所示:
由图可清楚地看出,在阴影部分①的区域内V(Na)>V(Mg)=V(Al)=11.2L,此时n>1mol, 在图所示的②,V(Na)=V(Mg)=V(Al)=11.2L,此时n=1, 在阴影部分③,V(Mg)=V(Al)=11.2L>V(Na),此时 在阴影部分④,V(Al)>V(Mg)>V(Na),此时 答案:①n>1 ②n=1 ③
|

练习册系列答案
相关题目