题目内容
下列现象或事实可用同一原理解释的是
- A.氯水和活性炭使红墨水褪色
- B.浓硫酸和石灰水长期暴露在空气中浓度降低
- C.漂白粉和水玻璃长期暴露在空气中变质
- D.SO2可使品红和酸性高锰酸钾溶液褪色
C
分析:A.氯水的漂白性是利用次氯酸的强氧化性,活性炭的漂白性是利用其吸附性;
B.浓硫酸有吸水性,石灰水能和二氧化碳反应生成碳酸钙;
C.次氯酸和硅酸的酸性都小于碳酸的酸性;
D.二氧化硫能和品红反应生成无色物质,能被酸性高锰酸钾氧化.
解答:A.氯水的漂白性是利用次氯酸的强氧化性,活性炭的漂白性是利用其吸附性,所以二者原理不同,故A错误;
B.浓硫酸有吸水性,石灰水能和二氧化碳反应生成难溶性的碳酸钙,所以浓硫酸和石灰水长期暴露在空气中浓度降低,但原理不同,故B错误;
C.次氯酸和硅酸的酸性都小于碳酸的酸性,所以漂白粉和硅酸钠都和碳酸反应生成次氯酸和硅酸,反应原理相同,故C正确;
D.二氧化硫能和品红反应生成无色物质,二氧化硫具有还原性,能被酸性高锰酸钾氧化,所以原理不同,故D错误;
故选C.
点评:本题考查了物质间的反应,明确物质的性质是解本题关键,明确这几种物质漂白性原理的异同.
分析:A.氯水的漂白性是利用次氯酸的强氧化性,活性炭的漂白性是利用其吸附性;
B.浓硫酸有吸水性,石灰水能和二氧化碳反应生成碳酸钙;
C.次氯酸和硅酸的酸性都小于碳酸的酸性;
D.二氧化硫能和品红反应生成无色物质,能被酸性高锰酸钾氧化.
解答:A.氯水的漂白性是利用次氯酸的强氧化性,活性炭的漂白性是利用其吸附性,所以二者原理不同,故A错误;
B.浓硫酸有吸水性,石灰水能和二氧化碳反应生成难溶性的碳酸钙,所以浓硫酸和石灰水长期暴露在空气中浓度降低,但原理不同,故B错误;
C.次氯酸和硅酸的酸性都小于碳酸的酸性,所以漂白粉和硅酸钠都和碳酸反应生成次氯酸和硅酸,反应原理相同,故C正确;
D.二氧化硫能和品红反应生成无色物质,二氧化硫具有还原性,能被酸性高锰酸钾氧化,所以原理不同,故D错误;
故选C.
点评:本题考查了物质间的反应,明确物质的性质是解本题关键,明确这几种物质漂白性原理的异同.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
有文献记载:在强碱性条件下,加热银氨溶液可能析出银镜.某同学进行如下验证和对比实验.
| 装置 | 实验序号 | 试管中的药品 | 现象 |
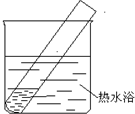 | 实验I | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生; 一段时间后,溶液逐渐变黑; 试管壁附着有银镜 |
| 实验II | 2mL银氨溶液和数滴浓氨水 | 有气泡产生; 一段时间后,溶液无明显变化 |
a.Ag(NH3)2++2H2O?Ag++2NH3+H2O
b.AgOH不稳定,极易分解为黑色Ag2O
(1)配制银氨溶液所需的药品是______.
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3,产生的现象是______.
②产生Ag2O的原因是______.
(3)该同学对产生银镜的原因提出瑕设:可能是NaOH还原Ag2O.实验及现象:向AgNO3溶液中加入______,出现黑色沉淀;水浴加热,未出现银镜.
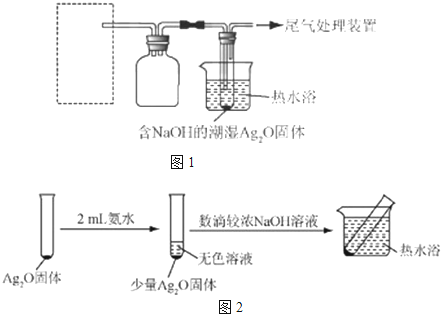
(4)重新假设:在NaOH存在下,可能是NH3还原Ag2O.用图1所示装置进行实验.现象:出现银镜.在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略).
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成.由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3还原Ag2O的反应.进行如图2实验:
①有部分Ag2O溶解在氨水中,该反应的化学方程式是______.
②实验结果证实假设成立,依据的现象是______.
(6)用HNO3清洗试管壁上的Ag,该反应的化学方程式是______.
 右图是硫酸试剂标签上的部分内容.下列说法正确的是
右图是硫酸试剂标签上的部分内容.下列说法正确的是







