题目内容
【题目】依据图中氮元素及其化合物的转化关系,回答问题:
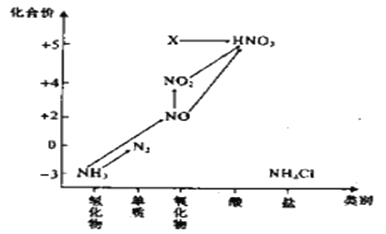
(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为________________________________________________________________。
(2)氮氧化物对大气污染主要的危害是____________________。(填一点即可)
(3)若要将NH3→N2,从原理上看,下列试剂可行的是_______________。
A.O2 B.Na
C.NH4Cl D.NO2
(4)图中X转化为HNO3的化学方程式为:____________________________________。
(5)图中在标准状况下将NO2、NO、O2混合并充满容器,将该容器倒置于水中,气体完全溶解,无气体剩余,若产物也不扩散,则所得溶液的物质的量浓度M,其数值大小范围为___________________________
【答案】 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 光化学烟雾、酸雨等 AD N2O5+2H2O=2HNO3 1/39.2<M<1/28
CaCl2+2NH3↑+2H2O 光化学烟雾、酸雨等 AD N2O5+2H2O=2HNO3 1/39.2<M<1/28
【解析】(1)实验室常用NH4Cl与Ca(OH)2反应生成氯化钙、氨气和水制取氨气,该反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;(2)氮氧化物对大气污染主要的危害是光化学烟雾、酸雨等;(3)若要将NH3→N2,氮元素化合价﹣3价变化为0价,氨气做还原剂被氧化,A.O2可以氧化氨气为氮气,选项A正确;B.Na是还原剂不能氧化氨气,选项B错误;C.NH4Cl中氮元素化合价﹣3价,不能和氨气反应生成氮气,选项C错误;D.NO2和氨气反应做氧化剂,氮元素化合价可以变化为0价,生成氮气,选项D正确;答案选AD;(4)图1分析可知X化合价与硝酸相同为+5价,物质类型为氧化物,X化学式为:N2O5,X转化为HNO3的化学方程式为:N2O5+H2O=2HNO3;(5)本题是有关NO2、NO和O2混合气体溶于水的计算问题,要解决这类问题应抓住两个基本反应及由它们演变出的两个反应(Ⅰ)、(Ⅱ),即:
CaCl2+2NH3↑+2H2O;(2)氮氧化物对大气污染主要的危害是光化学烟雾、酸雨等;(3)若要将NH3→N2,氮元素化合价﹣3价变化为0价,氨气做还原剂被氧化,A.O2可以氧化氨气为氮气,选项A正确;B.Na是还原剂不能氧化氨气,选项B错误;C.NH4Cl中氮元素化合价﹣3价,不能和氨气反应生成氮气,选项C错误;D.NO2和氨气反应做氧化剂,氮元素化合价可以变化为0价,生成氮气,选项D正确;答案选AD;(4)图1分析可知X化合价与硝酸相同为+5价,物质类型为氧化物,X化学式为:N2O5,X转化为HNO3的化学方程式为:N2O5+H2O=2HNO3;(5)本题是有关NO2、NO和O2混合气体溶于水的计算问题,要解决这类问题应抓住两个基本反应及由它们演变出的两个反应(Ⅰ)、(Ⅱ),即:
2NO+O2=2NO2……①
3NO2+H2O=2HNO3+NO……②
②×2+①得:
4NO2+O2+2H2O=4HNO3……(Ⅰ)
①×3+②×2得:
4NO+3O2+2H2O=4HNO3……(Ⅱ)
由(Ⅰ)、(Ⅱ)式中的系数要思考物质的量的变化,确定和寻找有关反应之间量的比例关系,反应物有无过量等等。
混合气体溶于水的气体体积等于所得溶液的体积,且溶液中溶质的物质的量等于溶于水的气体的物质的量,所得溶液的物质的量浓度为(V/22.4)/V = 1/22.4 (mol/L)
①若混合气体是NO2和O2,且体积比≤4:1,因为发生反应:4NO2+O2+2H2O=4HNO3,生成硝酸的物质的量是溶于水的气体物质的量的4/5,所得溶液的体积等于溶于水的气体体积,所以所得溶液的物质的量浓度为(V/22.4 ×4/5)/V = 1/28 (mol/L)
若混合气体是NO2和O2,且二者的体积比>4:1,所得溶液的物质的量浓度大于1/28(mol/L)
②若混合气体是NO和O2,且二者体积比≤3:4,因为发生反应:4NO+3O2+2H2O=4HNO3,生成硝酸的物质的量是溶于水的气体物质的量的4/7,所得溶液体积等于溶于水的气体体积,所得溶液的物质的量浓度为(V/22.4 ×4/7)/V = 1/39.2(mol/L);
综合①、②可知,所得溶液的物质的量浓度M,其数值大小范围为1/39.2<M<1/28。