题目内容
【题目】向500mLNaOH溶液中投入10.8g Al,二者恰好完全反应后,则参加反应的NaOH的物质的量为;原NaOH溶液的物质的量浓度为;生成标准状况下H2的体积为 .
【答案】0.4mol;0.8mol/L;13.44L
【解析】解:10.8gAl的物质的量= ![]() =0.4mol, 答:10.8gAl的物质的量为0.4mol.
=0.4mol, 答:10.8gAl的物质的量为0.4mol.
令参加反应的NaOH的物质的量为x mol、生成氢气的物质的量为y mol,则:
2Al+2H2O+2NaOH=2NaAlO2+3H2↑
2 2 3
0.4mol xmol ymol
所以,2:2=0.4mol:x mol,解得x=0.4
2:3=0.4mol:y mol,解得y=0.6
故NaOH溶液的物质的量浓度= ![]() =0.8mol/L,
=0.8mol/L,
标况下,生成氢气的体积为:0.6mol×22.4L/mol=13.44L
所以答案是:0.4mol; 0.8mol/L; 13.44L.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:
丙(见下表)
分子式 | C16H14O2 |
部分性质 | 能使Br2/CCl4褪色 |
能在稀H2SO4中水解 |
(1)甲的分子式为:
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
反应Ⅱ的化学方程式为(注明反应条件).
(3)已知:RCH═ CHR′ ![]() RCHO+R′CHO;2CHO
RCHO+R′CHO;2CHO ![]() HCOOH+CH3OH
HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
①下列物质不能与C反应的是(选填序号).
a.金属钠 b.乙酸 c.Na2CO3溶液 d. HBr
②写出F的结构简式 .
③D有多种同分异构体,任写其中一种能同时满足下列条件的异构体的结构简式 .
a.苯环上连接三种不同官能团 b.能发生银镜反应
c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色
④综上分析,丙的结构简式为 .
【题目】空气中SO2含量是重要的空气质量指标.
(1)某工厂SO2的排放量规定不得超过0.10mg/(L烟道气),为测定该工厂排放的烟道气中SO2的含量,某同学某次抽取了30.00L烟道气缓慢通过1L水,设SO2完全被吸收,设溶液体积为1L,用1.0×10﹣3mol/L的饱和碘水(密度为1g/cm3)滴定,反应为SO2+I2+2H2O═H2SO4+2HI,实验所记录数据如下:
溶有SO2的溶液体积 | 饱和碘水体积 | 指示剂 | |
第一次 | 25.00mL | 6.05 | 2~3滴淀粉 |
第二次 | 25.00mL | 7.20 | 2~3滴淀粉 |
第三次 | 25.00mL | 5.95 | 2~3滴淀粉 |
a.取25.00ml的烟道气的水溶液所用仪器名称是
b.滴定终点标志为
c.该厂排放的烟道气中SO2的含量为mg/(L烟道气)
(2)该同学在实验室还验证了SO2能否与BaCl2溶液反应的实验.二氧化硫通入氯化钡溶液中理论上不产生沉淀,但当他把SO2通入装有1mol/LBaCl2溶液的试管中后,出现了白色浑浊物.
a.该白色浑浊物为 , 产生该现象的原因可能是
b.为了避免产生沉淀,该同学设计了如下实验装置,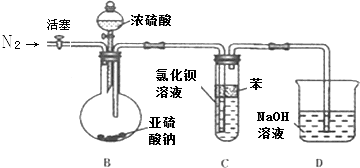
请回答下列问题
①反应开始前,先向制取SO2的装置中通入纯净的N2 , 其作用是: .
②该同学认为Ba(NO3)2溶液与BaCl2溶液一样在理论上与SO2也不会反应,请先判断正误(填“正确”、“错误”),如不正确则写出SO2与Ba(NO3)2溶液反应的化学方程式 .
