题目内容
将一定量的KClO3加热部分分解,然后向反应后混合物中加入足量的浓H2SO4,并加热,发生如下反应;KClO3+5KCl+3H2SO4![]() 3Cl2↑+3K2SO4+3H2O假设原KClO3物质的量为m,第一步反应KClO3分解率为a,两步反应生成的O2与Cl2总物质的量为n.
3Cl2↑+3K2SO4+3H2O假设原KClO3物质的量为m,第一步反应KClO3分解率为a,两步反应生成的O2与Cl2总物质的量为n.
(1)计算当氯元素全部转化为Cl2时的a值及n与m的函数关系式.
(2)讨论在a取不同值时,n与a、m的函数关系式及b的最大值.
答案:
解析:
解析:
|
解析: (1)当氯元素全部转化为Cl2时: 2KClO3=2KCl+3O2↑ 2 2 3 ma ma KClO3 + 5KCl+3H2SO4 1 5 3 m-ma ma (2)当0<a< 2KClO3~3O2↑ 5KCl~3Cl2 ma 即有 当 2KClO3~3O2↑ KCOl3~ 3Cl2 ma 当a= |

练习册系列答案
相关题目
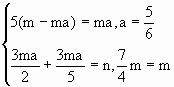
 3KClO4+KCl
。上述两个反应同时发生。
3KClO4+KCl
。上述两个反应同时发生。