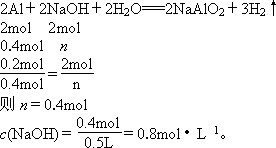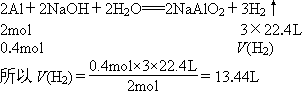题目内容
向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应后,计算:
(1)Al的物质的量.
(2)参加反应的NaOH的物质的量.
(3)标准状况下生成H2的体积.
答案:
解析:
解析:
|
答案:(1)0.4 mol (2)参加反应的NaOH的物质的量是0.4 mol,溶液的物质的量浓度是0.8 mol·L-1 (3)13.44 L 解析:根据物质的量、摩尔质量和质量之间的关系,n= (1)Al的摩尔质量是27 g·mol-1, n(Al)= (2)设参加反应的NaOH物质的量是n. 则 (3)设标准状况下生成的H2的体积是V(H2). |

练习册系列答案
相关题目