��Ŀ����
����Ŀ�������ʼ������������ǵ����������������ء�
(1)Fe3���Ļ�̬����۵����Ų�ʽΪ______��Ӧ��ԭ�ӽṹ�Ƚ�Fe��ͬ���ڵ�Mn����������(I3)�Ĵ�С��I3(Mn)_______I3(Fe)(��>��<����)��������_______��
(2)Fe��Fe2����Fe3��������CO��SCN����CN����H2NCONH2(����)�ȶ��������γɺܶ������
�������Fe(CO)5���۵㣭20�棬�е�103�棬�������Ʊ�������Fe(CO)5�Ľṹ��ͼ��ʾ��

���й���Fe(CO)5˵������ȷ����________��
A.Fe(CO)5�Ƿ��Ӿ���
B.Fe(CO)5��Feԭ�ӵ�������C22����Ϊ�ȵ�����
C.Fe(CO)5������������֮��Ϊ1��1
D.Fe(CO)5��Fe��5CO��Ӧ��û���»�ѧ������
��CN���ĵ���ʽΪ__________��
��H2NCONH2(����)��N��Cԭ�ӵ��ӻ���ʽ�ֱ�Ϊ__________��__________��
������ص�4��Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ__________��1 mol H2NCONH2(����)�����к�����������ĿΪ__________��
(3)NaCl��MgO���������ӻ����NaCl���۵�Ϊ801.3C��MgO���۵�ߴ�2800�档������־����۵������Ҫԭ����________��
(4)FexNy�ľ�����ͼ1��ʾ��Cu������ȫ����þ�����aλ�õ�Fe����bλ�õ�Fe���γ�Cu����Ͳ���Fe(x��n)CunNy��FexNyת��Ϊ����Cu������Ͳ���������仯��ͼ2��ʾ��������Բ��ȶ���Cu����Ͳ���Ļ�ѧʽΪ__________��

���𰸡�3d5 �� Mnԭ�Ӻ���ʧȥ2�����Ӻ���۵����Ų�ʽΪ3d5�����ڰ�������ȶ�״̬������ʧȥ���� D ![]() sp3 sp2 N��O��C��H 7NA ����þ�������������ӵİ뾶С��������������ܸ������۵���� FeCu3N
sp3 sp2 N��O��C��H 7NA ����þ�������������ӵİ뾶С��������������ܸ������۵���� FeCu3N
��������
(1)���ݹ���ԭ��д�۵����Ų�ʽ������ԭ�Ӻ�������Ų��Լ����ع���Ƚϵ����ܴ�С��
(2)��A. ���Ӿ����۷е�ϵͣ�
B. ��Ϊ�ȵ�����ķ��ӻ����Ӽ۵�������ȣ�ԭ�Ӹ�����ȣ�
C. Fe��CO�γ�5����λ����ÿ��CO�����к���1��������2��������
D. ��Ӧ�õ�Fe���ʣ��γɽ�������
��CN����N2��Ϊ�ȵ����壻
�۽�H2NCONH2(����)�Ľṹ��ʽд��![]() �����ݼ۲���ӶԻ��������Լ��ӻ���������ж�ԭ�ӵ��ӻ����ͣ�ͬһ����Ԫ�أ���һ����������ԭ��������������������ƣ�����IIA�塢��VA���һ�����ܴ���������Ԫ�أ�
�����ݼ۲���ӶԻ��������Լ��ӻ���������ж�ԭ�ӵ��ӻ����ͣ�ͬһ����Ԫ�أ���һ����������ԭ��������������������ƣ�����IIA�塢��VA���һ�����ܴ���������Ԫ�أ�
(3)�������Ӿ����۷е�ıȽϷ���˵�����ɣ�
(4)����Խ�ߣ�����Խ���ȶ����ɴ��ж�Cu����bλ�õ�Fe�������ߣ���Բ��ȶ����ٸ��ݾ�̯�������仯ѧʽ��
(1)FeΪ26��Ԫ�أ����ݹ���ԭ����д��Fe�۵����Ų�ʽΪ��3d64s2����ʧȥ4s�ܼ�2�����ӡ���ʧȥ3d�ܼ�1�������γ�Fe3+����Fe3���Ļ�̬����۵����Ų�ʽΪ3d5������Feԭ�Ӻ���ʧȥ2�����Ӻ���۵����Ų�ʽΪ3d6��Mnԭ�Ӻ���ʧȥ2�����Ӻ���۵����Ų�ʽΪ3d5�����ڰ�������ȶ�״̬������ʧȥ���ӣ���I3(Mn)��I3(Fe)���ʴ�Ϊ��3d5������Mnԭ�Ӻ���ʧȥ2�����Ӻ���۵����Ų�ʽΪ3d5�����ڰ�������ȶ�״̬������ʧȥ���ӣ�
(2)��A. Fe(CO)5���۷е�ܵͣ����ڷ��Ӿ��壬A����ȷ��
B. Fe(CO)5������ΪCO����C22����Ϊ�ȵ����壬B����ȷ��
C. Fe��CO�γ�5����λ����ÿ��CO�����к���1��������2����������Fe(CO)5����������ĿΪ10������������ĿΪ10������Fe(CO)5������������֮��Ϊ1��1��C����ȷ��
D. ��Ӧ�õ�Fe���ʣ��γɽ�������D����ʴ�Ϊ��D��
��CN����N2��Ϊ�ȵ����壬����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
�۽�H2NCONH2(����)�Ľṹ��ʽд��![]() ���ɴ˿�֪������N��Cԭ�ӵļ۲���Ӷ����ֱ�Ϊ4��3����N��Cԭ�ӵ��ӻ���ʽ�ֱ�Ϊsp3��sp2��ͬһ����Ԫ�أ���һ����������ԭ��������������������ƣ�����IIA�塢��VA���һ�����ܴ���������Ԫ�أ��⼸��Ԫ�ص�һ�����ܴ�С˳����N��O��C��H��1mol H2NCONH2(����)�����к�����������ĿΪ7NA���ʴ�Ϊ��sp3��sp2��N��O��C��H��7NA��
���ɴ˿�֪������N��Cԭ�ӵļ۲���Ӷ����ֱ�Ϊ4��3����N��Cԭ�ӵ��ӻ���ʽ�ֱ�Ϊsp3��sp2��ͬһ����Ԫ�أ���һ����������ԭ��������������������ƣ�����IIA�塢��VA���һ�����ܴ���������Ԫ�أ��⼸��Ԫ�ص�һ�����ܴ�С˳����N��O��C��H��1mol H2NCONH2(����)�����к�����������ĿΪ7NA���ʴ�Ϊ��sp3��sp2��N��O��C��H��7NA��
(3)NaCl��MgO���������ӻ��������þ�������������ӵİ뾶С��������������ܸ������۵���ߣ��ʴ�Ϊ������þ�������������ӵİ뾶С��������������ܸ������۵���ߣ�
(4)����Խ�ߣ�����Խ���ȶ�������ת�����������仯��֪��Cu����bλ�õ�Fe�������ߣ���Բ��ȶ������ݾ�̯����֪���þ�����Cuԭ�Ӹ���=![]() ��Feԭ�Ӹ���=
��Feԭ�Ӹ���=![]() ��Nԭ�Ӹ���Ϊ1�������仯ѧʽΪFeCu3N���ʴ�Ϊ��FeCu3N��
��Nԭ�Ӹ���Ϊ1�������仯ѧʽΪFeCu3N���ʴ�Ϊ��FeCu3N��

����Ŀ���������в������������ý��۲���ȷ����![]() ����
����![]()
��� | ���������� | ���� |
A | �� |
|
B | �� |
|
C | ��25mL��ˮ�ͷ�ˮ�зֱ����5�� | �¶����ߣ� |
D | ������ | ͬ�����ܽ�ȣ�
|
A. A B. B C. C D. D
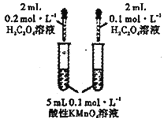
����Ŀ����.�������(K2FeO4)���м�ǿ�������ԣ���һ��������ˮ��������
��1�������FeO42-��ˮ��Ӧ�����ӷ���ʽ��4FeO42-��10H2O![]() 4Fe(OH)3��8OH����__��K2FeO4�ڴ���ˮ�Ĺ����������������___��____��
4Fe(OH)3��8OH����__��K2FeO4�ڴ���ˮ�Ĺ����������������___��____��
��2��������K2FeO4���Ƴ�c(FeO42-)��1.0mmol��L��1���������������ֱ�����20�桢30�桢40���60��ĺ���ˮԡ�У��ⶨc(FeO42-)�ı仯�������ͼ�ڣ�1�����еķ�ӦΪFeO42-�仯������Ӧ�����¶ȶԸ÷�Ӧ�ķ�Ӧ���ʺ�ƽ���ƶ���Ӱ����___��������Ӧ����H___0��

��.�±��Ǽ���������ʵĵ���ƽ�ⳣ�������ܵ���ʵ��ܶȻ�Ksp(25��)��
����� | ƽ�ⷽ��ʽ | ƽ�ⳣ��K | Ksp |
CH3COOH | CH3COOH | 1.76��10��5 | |
H2CO3 | H2CO3 HCO3- | K1=4.31��10��4 K2=5.61��10��11 | |
C6H5OH | C6H5OH | 1.1��10��10 | |
H3PO4 | H3PO4 H2PO4- | K1=7.52��10��3 K2=6.23��10��8 K3=2.20��10��13 | |
NH3��H2O | NH3��H2O | 1.76��10��5 | |
BaSO4 | BaSO4 | 1.07��10��10 | |
BaCO3 | BaCO3 | 2.58��10��9 |
�ش��������⣺
��1�����ϱ�����������CH3COOH����HCO3-����C6H5OH����H2PO4-���ɿ����ᣬ������������ǿ������˳��Ϊ___(����)��
��2��д��C6H5OH��Na3PO4��Ӧ�����ӷ���ʽ___��
��3��25��ʱ�����������Ũ�ȵĴ���Ͱ�ˮ��ϣ����Һ�У�c(CH3COO��)__c(NH4+)(����>��������������<��)��
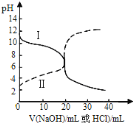
��4��25��ʱ����10mL0.01mol��L��1������Һ�еμ�VmL0.01mol��L��1��ˮ�����Һ������Ũ�ȹ�ϵ��ȷ����__��
A�������ҺpH>7����V��10
B�������ҺpH<7����c(NH4+)>c(C6H5O��)>c(H��)>c(OH��)
C��V��10ʱ�����Һ��ˮ�ĵ���̶�С��10mL0.01mol��L��1������Һ��ˮ�ĵ���̶�
D��V��5ʱ��2c(NH3��H2O)��2c(NH4
��5��ˮ�ⷴӦ�ǵ��͵Ŀ��淴Ӧ��ˮ�ⷴӦ�Ļ�ѧƽ�ⳣ����Ϊˮ�ⳣ��(��Kb��ʾ)����Ȼ�ѧƽ�ⳣ���Ķ��壬��д��Na2CO3��һ��ˮ�ⷴӦ��ˮ�ⳣ���ı���ʽ��___��