题目内容
a g Mg在盛有b L(标准状况)CO2和O2混合气体的密闭容器中燃烧.
(1)在密闭容器中可能发生的化学反应有________.
(2)若反应容器中CO2有剩余,则容器内的固体物质一定含有________.若反应容器有O2剩余,此时容器内固体物质的质量为________.
(3)若反应后容器中无气体剩余,则容器内固体物质的质量(m)的取值范围为_____________________________________(写出推导过程).
解析:
|
(1)2Mg+CO2 导解:可认为:Mg先同O2反应,当氧化反应完后,Mg再同CO2反应.当O2有剩余,说明镁全部反应生成氧化镁,Mg~MgO,则生成MgO的质量为 |

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案(1)需用胆矾______g。
(2)用一台天平先称量一只未知的空烧杯,试将称量过程中添退砝码的顺序排出来(现有砝码50 g、20 g、20 g、10 g、5 g、2 g、2 g、1 g以及500 mg、100 mg、50 mg共计12个)最终称得空烧杯为38.75 g(表示方法:添上“↑”,添上又退下为“↑↓”)。
砝码 |
|
|
|
|
|
|
|
|
|
|
|
|
添加 顺序 |
|
|
|
|
|
|
|
|
|
|
|
|
(3)然后称量到所需质量(烧杯+胆矾)。
将___________的砝码退下来,再添上______砝码后,向烧杯中加胆矾到平衡为止。
(4)配制方法设计五个操作:
①向盛有胆矾的烧杯中加入20 mL水使其溶解。
②继续往容量瓶中加水至液面接近刻度线2~3 cm。
③将CuSO4溶液沿玻璃棒注入50 mL容量瓶中。
④在烧杯加入少量的水,小心洗涤2~3次后移入容量瓶。
⑤改用胶头滴管加水至刻度线,加盖摇匀。
试用以上顺序编出正确顺序___________。
(5)a.定容时俯视刻度线。b.定容时仰视刻度线。c.所用的容量瓶事先用某种浓度的硫酸铜溶液润洗过。d.定容时加盖摇匀,装入用蒸馏水洗净的试剂瓶。
其中使实验结果偏高的有___________。
(14分)镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤:
主要的步骤总结如下:①把贝壳制成石灰乳 ②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀 ③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解法制取镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
Ⅱ.(1)铝、空气、海水可组成一种电池,广泛用于制造航标灯。此电池正极的电极反应为 。
(2)铝热还原法是冶炼熔点较高的金属的一种重要方法,焊接钢轨即用到此法。将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,
下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作
化学方程式 。
(3)为确定某铝热剂(氧化铁粉末和铝粉)的组成,分别进行下列实验。
若取10.7g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况)体积为3.36L,反应的化学方程式为 ,样品中铝的质量是 g。
若取10.7g样品将其点燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体体积为aL,该气体与上小题中所得气体的体积比等于 ∶ 。
 2MgO+C,C+O2
2MgO+C,C+O2 CO2,2Mg+O2
CO2,2Mg+O2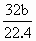 <m<a+
<m<a+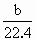 ×44反应后无气体剩余,说明气体全部反应,气体的质量都转化成固体增加的质量,所以,当b L全部为CO2时,气体全部反应后,固体质量应为a+
×44反应后无气体剩余,说明气体全部反应,气体的质量都转化成固体增加的质量,所以,当b L全部为CO2时,气体全部反应后,固体质量应为a+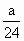 ×40=
×40=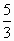 a g.
a g. 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10lkPa,温度为0℃,锌的相对原子质量为65).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10lkPa,温度为0℃,锌的相对原子质量为65).