题目内容
6.下列说法正确的是( )| A. | 热化学方程式的计量数可以表示分子的个数 | |
| B. | 热化学方程式中只需标明生成物的状态 | |
| C. | 反应热指的是反应过程中放出或吸收的热量 | |
| D. | 伴随能量变化的一定是化学变化 |
分析 A、热化学方程式的化学计量数只表示物质的量;
B、反应热与物质的聚集状态有关;
C、依据反应热的概念分析判断;
D、伴随能量变化也有物理变化.
解答 解:A、热化学方程式的化学计量数只表示物质的量,不可表示分子的个数,故A错误;
B、反应热与物质的聚集状态有关,所以在热化学方程式中无论反应物还是生成物都必须标明聚集状态,故B错误;
C、反应热是一定条件下的化学反应吸收和放出的热量,故C正确;
D、伴随能量变化也有物理变化,如浓硫酸的溶解是放热,故D错误;
故选C.
点评 本题考查热化学方程式的含义和书写方法应用,焓变的表达意义,注意化学计量数只表示物质的量,不表示微粒数,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.同温同压下,下列关于氢气和氯气的叙述中,正确的是( )
①等体积的氢气和氯气所含的分子数相同
②氢分子间的平均距离和氯分子间的平均距离几乎是相等的
③氢分子与氯分子的大小相同
④氢分子和氯分子本身的大小对于气体体积影响可以忽略不计.
①等体积的氢气和氯气所含的分子数相同
②氢分子间的平均距离和氯分子间的平均距离几乎是相等的
③氢分子与氯分子的大小相同
④氢分子和氯分子本身的大小对于气体体积影响可以忽略不计.
| A. | ①②③ | B. | ①②④ | C. | ①②③④ | D. | ①④ |
17. 为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
Ⅰ.AgNO3的热稳定性
利用如图所示的实验装置,加热A中的AgNO3固体,试管A中有红棕色气体产生,B中无红棕色气体产生,在装置C中收集到无色气体.当反应结束后,测得试管中残留黑色固体Ag.(夹持及加热仪器均省略)
(1)C中集气瓶收集的气体为氧气,要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(2)甲同学认为仅凭试管A中有红棕色的气体产生就判定有NO2产生是错误的,因为无色NO遇到空气也会变成红棕色,所以加热前应当排净装置中的空气,你是否同意他的观点?并说明理由:否;硝酸银分解生成氧气.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入盛有AgNO3溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,猜测如下:
假设一:Fe被氧化成Fe2+;
假设二:Fe被氧化成Fe3+;
假设三:Fe被氧化成Fe2+或Fe3+.
已知:溶液中的Ag+能与SCN-反应,干扰实验.选用如下试剂设计一个实验验证假设三.可选用的试剂:KSCN溶液、酸性KMnO4溶液、氯水、盐酸、硝酸、NaCl溶液.完成如表:
实验结论:Fe的氧化产物为Fe2+和Fe3+.
 为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.Ⅰ.AgNO3的热稳定性
利用如图所示的实验装置,加热A中的AgNO3固体,试管A中有红棕色气体产生,B中无红棕色气体产生,在装置C中收集到无色气体.当反应结束后,测得试管中残留黑色固体Ag.(夹持及加热仪器均省略)
(1)C中集气瓶收集的气体为氧气,要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(2)甲同学认为仅凭试管A中有红棕色的气体产生就判定有NO2产生是错误的,因为无色NO遇到空气也会变成红棕色,所以加热前应当排净装置中的空气,你是否同意他的观点?并说明理由:否;硝酸银分解生成氧气.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入盛有AgNO3溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,猜测如下:
假设一:Fe被氧化成Fe2+;
假设二:Fe被氧化成Fe3+;
假设三:Fe被氧化成Fe2+或Fe3+.
已知:溶液中的Ag+能与SCN-反应,干扰实验.选用如下试剂设计一个实验验证假设三.可选用的试剂:KSCN溶液、酸性KMnO4溶液、氯水、盐酸、硝酸、NaCl溶液.完成如表:
| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | 白色沉淀 | 除尽Ag+ |
| (2)取少量上层清液于试管中,加入取少量上述溶液于试管中加入 KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上层清液于试管中,加入加入 酸性KMnO4溶液,振荡 | 紫红色消失 | 存在Fe2+ |
14.在下列各组离子中,能大量共存的且溶液呈无色是( )
| A. | Na+、H+、Al3+、CH3COO- | B. | Mg2+、HCO3-、Ca2+、NO3- | ||
| C. | K+、MnO4-、Cl-、Cu2+ | D. | NH4+、Cl-、K+、OH- |
18.下列离子方程式中,正确的是( )
| A. | 稀硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| B. | 铁与氯化铁溶液反应:Fe+2Fe3+═3Fe2+ | |
| C. | 实验室制氯气:MnO2+4HCl═Mn2++2Cl-+Cl2↑+2H2O | |
| D. | 向氯化铝溶液滴加少量氨水:Al3++3OH-═Al(OH)3↓ |
15.如图是一种合金材料储氢后的晶胞结构示意图,该晶体中X、Y、Z微粒的个数比为( )
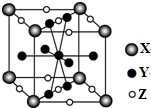

| A. | 1:1:1 | B. | 1:3:3 | C. | 4:4:5 | D. | 1:5:3 |
16.NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,2g 氢气所含原子数目为2NA | |
| B. | 36g H2O中含有的质子数为10NA | |
| C. | 标准状况下,11.2L水中含有的分子数是0.5NA | |
| D. | 1mol 氯气与足量水反应,转移的电子数是2NA |

 .
.