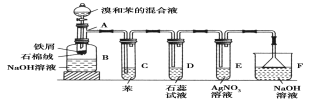
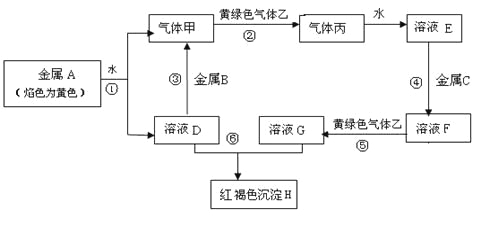
题目内容
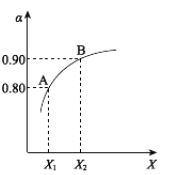
【题目】在一定条件下,氮气与氢气合成氨气的能量变化的曲线如图,下列叙述正确的是( )
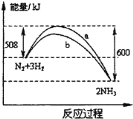
A.a历程使用了催化剂,b历程没有使用催化剂
B.使用催化剂可提高氮气的转化率
C.相同状况下,lmol氮气和3mol氢气总键能高于2mol氨气的总键能
D.该反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ·mol-1
2NH3(g) △H=-92kJ·mol-1
【答案】D
【解析】
A. 催化剂可以降低活化能,如图所示,a历程未使用催化剂,b历程使用催化剂,故A错误;
B. 使用催化剂可以改变反应速率,但对反应平衡没有影响,所以不能提高氮气的转化率,故B错误;
C. 根据图示,该反应为放热反应,焓变小于零,所以相同状况下,lmol氮气和3mol氢气总键能低于2mol氨气的总键能,故C错误;
D. 根据图示,lmol氮气和3mol氢气完全反应生成2mol氨气时,放出的热量为600kJ-508 kJ =92kJ ,根据热化学方程式书写规则得:N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ·mol-1,故D正确;
2NH3(g) △H=-92kJ·mol-1,故D正确;
故选D。

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目