题目内容
(1)在下列反应中:A.2F2+2H2O=4HF+O2↑;B.2Na+2H2O=2NaOH+H2↑;C.CaO+H2O=Ca(OH)2;
D.2H2O
2H2↑+O2↑.其中(填序号):
①水是氧化剂的是 ,②水是还原剂的是 ,③水既是氧化剂,又是还原剂的是 ,④水既不是氧化剂,又不是还原剂的是 .
(2)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应并用“单线桥法”表示出电子转移的方向和数目: ,当化学反应中电子转移的数目为3.01×1023个时,则生成的氯气在标准状况时的体积为 L.
D.2H2O
| ||
①水是氧化剂的是
(2)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应并用“单线桥法”表示出电子转移的方向和数目:
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)①水中H元素的化合价降低,则水为氧化剂;
②水中O元素的化合价升高,则水为还原剂;
③水中H元素的化合价降低,O元素的化合价升高,则水既是氧化剂,又是还原剂;
④没有元素的化合价变化,则水既不是氧化剂,又不是还原剂;
(2)MnO2与浓盐酸混合加热,反应生成氯化锰、氯气和水,反应中Mn元素的化合价由+4价降低为+2价,该反应转移2e-,以此来解答.
②水中O元素的化合价升高,则水为还原剂;
③水中H元素的化合价降低,O元素的化合价升高,则水既是氧化剂,又是还原剂;
④没有元素的化合价变化,则水既不是氧化剂,又不是还原剂;
(2)MnO2与浓盐酸混合加热,反应生成氯化锰、氯气和水,反应中Mn元素的化合价由+4价降低为+2价,该反应转移2e-,以此来解答.
解答:
解:(1)①水中H元素的化合价降低,则水为氧化剂,只有B中水为氧化剂,故答案为:B;
②水中O元素的化合价升高,则水为还原剂,只有A中水为还原剂,故答案为:A;
③水中H元素的化合价降低,O元素的化合价升高,则水既是氧化剂,又是还原剂,只有D中符合,故答案为:D;
④没有元素的化合价变化,则水既不是氧化剂,又不是还原剂,只有C中没有元素的化合价变化,符合,故答案为:C;
(2)MnO2与浓盐酸混合加热,反应生成氯化锰、氯气和水,反应中Mn元素的化合价由+4价降低为+2价,该反应转移2e-,用“单线桥法”表示氧化还原反应中电子转移情况为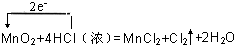 ,由反应可知,转移2mol电子生成1molCl2,则电子转移的数目为3.01×1023个时,生成氯气为0.5mol×
,由反应可知,转移2mol电子生成1molCl2,则电子转移的数目为3.01×1023个时,生成氯气为0.5mol×
×22.4L/mol=5.6L,故答案为: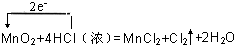 ;5.6.
;5.6.
②水中O元素的化合价升高,则水为还原剂,只有A中水为还原剂,故答案为:A;
③水中H元素的化合价降低,O元素的化合价升高,则水既是氧化剂,又是还原剂,只有D中符合,故答案为:D;
④没有元素的化合价变化,则水既不是氧化剂,又不是还原剂,只有C中没有元素的化合价变化,符合,故答案为:C;
(2)MnO2与浓盐酸混合加热,反应生成氯化锰、氯气和水,反应中Mn元素的化合价由+4价降低为+2价,该反应转移2e-,用“单线桥法”表示氧化还原反应中电子转移情况为
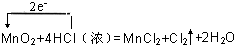 ,由反应可知,转移2mol电子生成1molCl2,则电子转移的数目为3.01×1023个时,生成氯气为0.5mol×
,由反应可知,转移2mol电子生成1molCl2,则电子转移的数目为3.01×1023个时,生成氯气为0.5mol×| 1 |
| 2 |
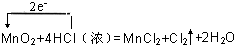 ;5.6.
;5.6.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意单线桥法表示氧化还原反应中电子转移,侧重基本概念及转移电子的考查,题目难度中等.

练习册系列答案
相关题目
NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、1.0L 1.0mol?L-1的NaAlO2溶液中含有的氧原子数为2NA |
| B、标准情况下,22.4L SO3中的原子总数为4NA |
| C、3.01×1023个一氧化碳分子所占体积是11.2L |
| D、25.5g NH3在标准状况下所占的体积为33.6L |
下列热化学方程式或离子方程式中,正确的是( )
| A、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 |
| B、在常温常压下,将0.5mol 硫放中足量氧气中充分反应生成SO2(g),放热148kJ,其热化学方程式为:S(s)+O2(g)═SO2(g)△H=+296kJ?mol-1 |
| C、氧化铝溶于NaOH溶液:Al2O3+OH-+H2O═Al(OH)3 |
| D、氯化镁溶液与氢氧化钾溶液反应:Mg2++2OH-=Mg(OH)2↓ |
把2.3g Na放入水中,要使100个水分子中含有1个Na+,所需水的质量是( )
| A、184g |
| B、181.8g |
| C、180g |
| D、183.6g |
 置换反应的通式可表示为如图:单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
置换反应的通式可表示为如图:单质甲、乙和化合物A、B为中学常见物质,请回答下列问题: