题目内容
已知下列热化学方程式:
 CH4(g)+O2(g)=
CH4(g)+O2(g)=  C02(g)+H2O(1);?H =-445.15kJ·mol-1
C02(g)+H2O(1);?H =-445.15kJ·mol-1
CH4(g)+ O2(g)=CO(g)+2H2O(1); ?H=-607.3kJ·mol-1
O2(g)=CO(g)+2H2O(1); ?H=-607.3kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(1); ?H ="-890.3" kJ·mol-1
CH4(g)+2O2(g)=CO2(g)十2H2O(g); ?H ="-802.3" kJ·mol-1
则CH4的燃烧热为
 CH4(g)+O2(g)=
CH4(g)+O2(g)=  C02(g)+H2O(1);?H =-445.15kJ·mol-1
C02(g)+H2O(1);?H =-445.15kJ·mol-1CH4(g)+
 O2(g)=CO(g)+2H2O(1); ?H=-607.3kJ·mol-1
O2(g)=CO(g)+2H2O(1); ?H=-607.3kJ·mol-1CH4(g)+2O2(g)=CO2(g)+2H2O(1); ?H ="-890.3" kJ·mol-1
CH4(g)+2O2(g)=CO2(g)十2H2O(g); ?H ="-802.3" kJ·mol-1
则CH4的燃烧热为
| A.445.15 kJ·mol-1 | B.607.3 kJ·mol-1 | C.890.3 kJ·mol-1 | D.802.3 kJ·mol-1 |
C
燃烧热是在一定条件下,1mol可燃物完全燃烧,生成稳定的氧化物时所放出的热量,水的稳定状态是液态,所以正确的答案选C。

练习册系列答案
相关题目
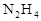 作燃料,
作燃料,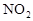 作氧化剂,两者反应生成N2和水蒸气,已知:
作氧化剂,两者反应生成N2和水蒸气,已知: △H1=+67.7kJ/mol
△H1=+67.7kJ/mol O2(g)=== Al2O3(s) △H=" -1" 644.3 kJ? mol-1
O2(g)=== Al2O3(s) △H=" -1" 644.3 kJ? mol-1


 2NH3(g), △H = -92kJ·mol-1
2NH3(g), △H = -92kJ·mol-1