题目内容
[化学一选修2:化学与技术](15分)
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:

金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。

【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在________左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为____________________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是____________________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是__________________________________________。
(1)Cu(OH)2+2H+=Cu2++2H2O 3
(2)2 Cu2++2Cl-+Fe=2CuCl↓+Fe2+
(3)加快乙醇和水的蒸发,防止CuCl被空气氧化
(4)Na2SO4和FeSO4 不同温度下硫酸钠和硫酸亚铁的溶解度
(5)2 CuSO4+ Na2SO3+2NaCl+ H2O=2CuCl↓+2 Na2SO4+ H2SO4
OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率。但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降低了CuCl的产率。
【解析】
试题分析:(1)pH=4时铁离子的浓度为0,所以酸浸时主要发生的离子反应是产生的氢氧化铜沉淀和酸的反应,离子方程式是Cu(OH)2+2H+=Cu2++2H2O;根据图像可得,CuCl的产率最高点对应的pH值是3;
(2)Fe、氯化钠、硫酸铜发生反应生成CuCl沉淀,则Cu元素的化合价降低,所以Fe元素的化合价升高,则发生离子的方程式是2 Cu2++2Cl-+Fe=2CuCl↓+Fe2+
(3)因为CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐,所以70℃真空干燥、密封包装的目的是加快乙醇和水的蒸发,防止CuCl被空气氧化;
(4)根据Fe、氯化钠、硫酸铜发生的反应判断,产品滤出时所得滤液的主要分成Na2SO4和FeSO4;若想从滤液中获取FeSO4·7H2O晶体,需将二者分离,所以还需要知道的是不同温度下硫酸钠和硫酸亚铁的溶解度,从而利用溶解度的不同分离二者;
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,则亚硫酸钠起到还原剂的作用,亚硫酸根离子被氧化为硫酸根离子,反应的化学方程式为:2 CuSO4+ Na2SO3+2NaCl+ H2O=2CuCl↓+2 Na2SO4+ H2SO4;
为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率。但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降低了CuCl的产率,所以控制pH至3.5.
考点:考查物质制备流程的分析,反应产物的判断,化学方程式的书写,对图像的分析


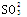 = H2O+SO2↑的化学反应个数有
= H2O+SO2↑的化学反应个数有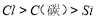
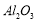 在工业上用于制作耐高温材料,也用于电解法治炼铝
在工业上用于制作耐高温材料,也用于电解法治炼铝