题目内容
17.设NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物中所含的氯原子数介于NA至2NA之间 | |
| B. | 0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L | |
| C. | 0.2 mol•L-1 Na2S溶液中含有的S2-数目小于0.2NA | |
| D. | 在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中每溶解1 mol Zn,转移的电子数大于2NA |
分析 A、标况下,二氯甲烷为液态;
B、生成气体所处的状态不明确;
C、溶液体积不明确;
D、在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中,锌和NH4NO3做还原剂,HNO3做氧化剂.
解答 解:A、标况下,二氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、0.1 mol Cu与足量热的浓硫酸反应生成SO2的物质的量为0.1mol,但由于生成气体所处的状态不明确,不一定是标况下,故体积不一定是2.24L,故B错误;
C、溶液体积不明确,故溶液中的S2-数目不能计算,故C错误;
D、在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中,锌和NH4NO3做还原剂,HNO3做氧化剂,此反应转移5mol电子时溶解1mol锌,故当溶解1mol锌时转移的电子数大于2NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.下列说法正确的是( )
| A. | 分子式为C5H12的同分异构体中,一氯代物仅有一种的有机物一定是2,2一二甲基戊烷. | |
| B. | 若某高分子化合物对应的单体有两种,则此高聚物一定是通过缩聚反应得到的. | |
| C. | 等物质的量的乙烯和乙醇在足量氧气中完全燃烧,消耗O2和生成CO2的量相等 | |
| D. | 苯丙氨酸的结构为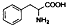 ,分子式为C9H10NO2,它既能与酸反应又能与碱反应. ,分子式为C9H10NO2,它既能与酸反应又能与碱反应. |
6.下列说法不正确的是( )
| A. | 在船外壳镶嵌锌块保护船身,锌为原电池的负极 | |
| B. | MgO的熔点高于NaCl,是因为MgO的晶格能大于NaCl | |
| C. | 1molFeCl3完全水解将产生6.02×1023个胶体粒子 | |
| D. | 水的离子积常数Ksp随着温度的升高而增大,说明水的电离是吸热过程 |
7.T、W、X、Y、Z为前四周期元素,其原子序数依次增大,有关五种元素的性质或原子结构描述如下:
(1)Z元素位子周期表中第_VIII族,其基态原子的价层电子排布式为:3d64s2;
(2)T的一种化合物为T2H4,该分子中极性键和非极性键的数目之比为4:1:T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于离子晶体.
(3)W、X和Y三种元素中,第一电离能最小的为Na(填元素符号);W、X和Y的简单离子的半径从小到大的顺序为Na+<Cl-<S2-(用离子符号表示).
(4)Z与水蒸气反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
| 元素符号 | 元素性质或原子结构 |
| T | 其一种无色氧化物遇空气变为红棕色 |
| W | 其单质和化合物的焰色反应焰色均呈黄色 |
| X | 基态原子的最外层电子排布式为(n+1)sn(n+1)pn+2 |
| Y | 单质常温下为气体,可用于自来水消毒 |
| Z | 一种核素的质量数为56,中子数为30 |
(2)T的一种化合物为T2H4,该分子中极性键和非极性键的数目之比为4:1:T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于离子晶体.
(3)W、X和Y三种元素中,第一电离能最小的为Na(填元素符号);W、X和Y的简单离子的半径从小到大的顺序为Na+<Cl-<S2-(用离子符号表示).
(4)Z与水蒸气反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题: As、N、0等非金属元素的化合物在工业生产中有重要的应用.
As、N、0等非金属元素的化合物在工业生产中有重要的应用.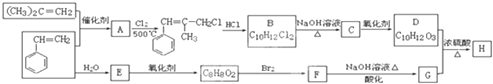
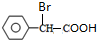 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$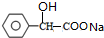 +NaBr+H2O.
+NaBr+H2O.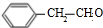 .
.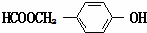 (写结构简式).
(写结构简式). 已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大.A的一种单质是自然界硬度最大的物质,B是地壳中含量最多的元素,C的单质能从B的一种氢化物中置换出B的一种单质,D是人体骨骼中的常见元素,D的氢氧化物常用来检验A和B形成的一种化合物,F的原子序数比E大1,F是Ⅷ族元素中原子序数最小的一种元素.
已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大.A的一种单质是自然界硬度最大的物质,B是地壳中含量最多的元素,C的单质能从B的一种氢化物中置换出B的一种单质,D是人体骨骼中的常见元素,D的氢氧化物常用来检验A和B形成的一种化合物,F的原子序数比E大1,F是Ⅷ族元素中原子序数最小的一种元素.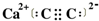 .
.