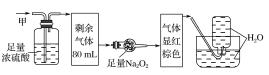
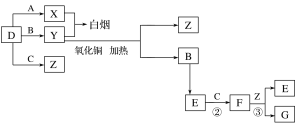
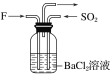
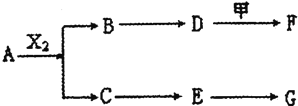题目内容
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑,若氧化产物比还原产物多1.75 mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况)B.有0.250 mol KNO3被氧化
C.转移电子的物质的量为2.5 molD.被氧化的N原子的物质的量为3.75 mol
【答案】D
【解析】
10NaN3+2KNO3=K2O+5Na2O+16N2↑:NaN3中N的化合价升高,NaN3为还原剂,KNO3中N的化合价降低,KNO3为氧化剂,据此分析。
10NaN3+2KNO3=K2O+5Na2O+16N2↑:NaN3中N的化合价升高,NaN3为还原剂,根据原子守恒,10NaN3~15N2,KNO3中N的化合价降低,KNO3为氧化剂,2KNO3~N2,氧化产物比还原产物多14mol,
A. 根据上述分析,当产生16molN2时,氧化产物比还原产物多14mol,因此当多1.75mol时,产生N2的物质的量为![]() =2mol,则生成标准状况下氮气的体积为44.8L,故A错误;
=2mol,则生成标准状况下氮气的体积为44.8L,故A错误;
B. 根据上述分析,KNO3中N的化合价降低,发生还原反应,被还原,故B错误;
C. 当氧化产物比还原产物多14mol时,转移电子物质的量为10mol,因此多1.75mol时,转移电子物质的量为![]() =1.25mol,故C错误;
=1.25mol,故C错误;
D. 根据上述分析,当氧化产物比还原产物多14mol时,有30molN原子被氧化,则多1.75mol时,被氧化的N原子物质的量为![]() =3.75mol,故D正确;
=3.75mol,故D正确;
答案:D。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色 | 说明该食盐试样不含KIO3 |
B | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡: |
D | 室温下向CuCl2和少量FeCl3的混合溶液中,加入铜屑,充分搅拌,过滤,得蓝绿色溶液 | 除去杂质FeCl3得纯净CuCl2溶液 |
A.AB.BC.CD.D