题目内容
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、pH=l的溶液中:Mg2+、Na+、AlO2-、SO42- |
| B、含有大量NO3-的溶液中:H+、Na+、Fe3+、Cl- |
| C、含有0.1 mol?L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- |
| D、含有大量MnO4-的溶液中:Ca2+、K+、Cl-、I- |
考点:离子共存问题
专题:离子反应专题
分析:A.pH=l的溶液,显酸性;
B.该组离子之间不反应;
C.离子之间发生氧化还原反应;
D.离子之间发生氧化还原反应.
B.该组离子之间不反应;
C.离子之间发生氧化还原反应;
D.离子之间发生氧化还原反应.
解答:
解:A.pH=l的溶液,显酸性,H+、AlO2-结合生成沉淀,不能共存,故A错误;
B.该组离子之间不反应,可大量共存,故B正确;
C.Fe3+、I-离子之间发生氧化还原反应,不能大量共存,故C错误;
D.MnO4-、I-离子之间发生氧化还原反应,不能大量共存,故D错误;
故选B.
B.该组离子之间不反应,可大量共存,故B正确;
C.Fe3+、I-离子之间发生氧化还原反应,不能大量共存,故C错误;
D.MnO4-、I-离子之间发生氧化还原反应,不能大量共存,故D错误;
故选B.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
下列有机物转化过程中涉及的反应属于取代反应的是( )


| A、① | B、② | C、③ | D、④ |
往某溶液中通入过量氯气,再滴入Ba(NO3)2和HNO3溶液后,溶液中有白色沉淀,原溶液可能是( )
| A、AgNO3 |
| B、Na2SO3 |
| C、Na2CO3 |
| D、CaCl2 |
下列关于碱金属元素的叙述错误的是( )
| A、随核电荷数递增,碱金属单质的熔沸点逐渐减小 |
| B、随核电荷数递增,碱金属单质的密度逐渐增大(Na、K反常) |
| C、碱金属元素包括F、Cl、Br、I、At五种元素 |
| D、碱金属元素的原子最外层都只有一个电子 |
下列离子方程式中正确的是( )
| A、石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O |
| B、硫酸铝溶液中滴加过量氨水:Al3++4OH-=AlO2-+2H2O |
| C、FeBr2溶液与足量Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
| D、向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3?H2O+H2O |
一定能在下列溶液中大量共存的离子组是( )
| A、25℃时,c(H+)=1×10-2mol/L的溶液中:Na+、NH4+、CO32-、SO42- |
| B、25℃时,水电离产生的c(H+)=1×10-12mol/L溶液中:Fe2+、Ca2+、I-、NO3- |
| C、含有大量Fe3+的溶液中:NH4+、Na+、Cl-、HCO3- |
| D、能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32- |
 某固体酸性燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
某固体酸性燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )| A、电子通过外电路从b极流向a极 |
| B、每转移0.1mol电子,消耗1.12L的H2 |
| C、H+由a极通过固体酸电解质传递到b极 |
| D、b极上的电极反应式为:O2+2H2O+4e-═4OH- |
下列关于铁及其化合物的说法中,不正确的是( )
| A、自然界中存在游离态铁 |
| B、铁在氧气中燃烧生成Fe2O3 |
| C、某些含铁的化合物可用作水处理剂 |
| D、铁红(Fe2O3)常用作红色油漆和涂料 |
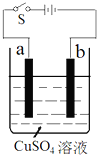 如图是电解精炼铜的装置示意图.回答下列问题:
如图是电解精炼铜的装置示意图.回答下列问题: