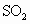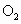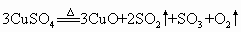题目内容
 在一定条件下发生如下分解反应:
在一定条件下发生如下分解反应: 有人设计通过实验测定反应产生的
有人设计通过实验测定反应产生的 、
、 、
、 物质的量的方法,并经计算确定该条件下分解反应式中各物质的化学计量数.实验可能用到的仪器如图所示.
物质的量的方法,并经计算确定该条件下分解反应式中各物质的化学计量数.实验可能用到的仪器如图所示.
实验测得数据及有关结果如下:①准确称取6.0g无水 ;②干燥管总质量在实验结束时增加了2.4g;③测出量筒中水的体积后,折算成排水的气体在标准状况下的体积为280ml;④实验结束时,装置F中的溶液变为
;②干燥管总质量在实验结束时增加了2.4g;③测出量筒中水的体积后,折算成排水的气体在标准状况下的体积为280ml;④实验结束时,装置F中的溶液变为 溶液(不含其他杂质).
溶液(不含其他杂质).

(1)按装置从左至右的方向,各仪器接口连接顺序为________(填序号).
(2)装置F的作用是________.
(3)装置D的作用是________.
(4)确定装置E的进、出口的原则是:________.
(5)首先应计算的是物质________的体积;通过计算,推断出该条件下反应的化学方程式:________
(6)该实验设计中,可能给测定带来误差最大的装置是(填代号)________.
答案:
解析:
解析:
|
(1)①⑨⑩⑥⑤③④⑧⑦② (2)吸收 (3)干燥 (4)保证气体将瓶中水压出,进入量筒 (5) (6)E |

练习册系列答案
相关题目
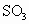 ,放出等物质的量的
,放出等物质的量的