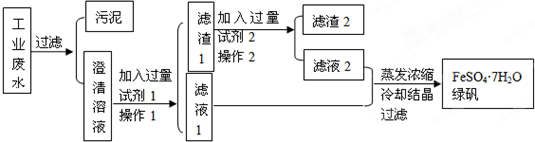
题目内容
3.实验室用下列装置制取氯气,并进行后面的实验,请完成下列问题:
(1)A、B各放什么物质?A浓盐酸,B二氧化锰,化学反应方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置D是为了除去Cl2中的氯化氢气体,D中应放入下列溶液中的D.
A.NaOH溶液 B.水 C.AgNO3溶液 D饱和食盐水
(3)E装置是为了使氯气干燥,装置中应放入下列的C.
A.NaOH溶液 B.碱石灰 C.浓H2SO4D.饱和食盐水
(4)F装置中为干的红布条,观察到的现象是不退色,原因是氯气不具有漂白性.
(5)G装置中放入石蕊试液,观察到的现象是溶液先变红色后褪色,反应化学方程式为Cl2+H2O=HCl+HClO.
(6)H装置中放入NaBr溶液反应的化学方程式为Cl2+2NaBr=2NaCl2+Br2.
(7)I装置中放入KI淀粉溶液,观察到的现象是溶液变蓝色.
(8)J装置中放入NaOH溶液,其作用是吸收过量的氯气,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
分析 实验室常用二氧化锰和浓盐酸在加热条件下生成氯气;制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,可以用盛有饱和食盐水的洗气瓶除去氯气中的氯化氢;浓硫酸具有吸水性,能够干燥氯气,氯气不具有漂白性,氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,能够使有色布条褪色,氯水中含有盐酸和次氯酸既有酸性又有漂白性,遇到石蕊溶液,先变红色后褪色,氯气氧气性强于溴、碘,能够置换溴单质和碘单质,氯气有毒,与氢氧化钠溶液反应,过量的氯气可以用氢氧化钠溶液吸收.
解答 解:(1)实验室常用二氧化锰和浓盐酸在加热条件下生成氯气,所以A中放入浓盐酸,B中放二氧化锰,方程式:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:浓盐酸;二氧化锰;MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,可以用盛有饱和食盐水的洗气瓶除去氯气中的氯化氢,
故选:D;
(3)浓硫酸具有吸水性,用来干燥氯气,故选:C;
(4)氯气不具有漂白性,所以干燥的氯气通过F中有色布条不退色,
故答案为:不退色;氯气不具有漂白性;
(5)氯气与水反应生成盐酸和次氯酸,方程式:Cl2+H2O=HCl+HClO,盐酸具有酸性,遇到石蕊溶液变红色,而次氯酸具有漂白性,能够使变红色的石蕊溶液褪色;
故答案为:溶液先变红色后褪色;Cl2+H2O=HCl+HClO;
(6)氯气与溴化钠反应生成氯化钠和溴,方程式:Cl2+2NaBr=2NaCl2+Br2;
故答案为:Cl2+2NaBr=2NaCl2+Br2;
(7)氯气氧化性强于碘,碘遇到淀粉变蓝色;
故答案为:溶液变蓝色;
(8)氯气有毒,直接排放能够引起污染,氯气与氢氧化钠反应生成氯化钠和次氯酸钠和水,方程式:Cl2+2NaOH=NaCl+NaClO+H2O,可以用氢氧化钠溶液吸收;
故答案为:吸收过量的氯气;Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查了氯气的制备和性质的检验,熟悉制备原理和氯气、次氯酸的性质是解题关键,题目难度不大.

| A. | 过氧化钙的化学式是Ca2O2 | |
| B. | 1mol过氧化钠和过氧化钙的混合物中,阴影离子数个数比为1:2 | |
| C. | 过氧化钙与足量水反应生成0.5mol氧气时,转移的电子数为2NA | |
| D. | 过氧化钠和过氧化钙都可作漂白剂 |
| A. | 热稳定性:H2O>HF>H2S | |
| B. | NH4Cl的电子式: | |
| C. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | |
| D. | 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
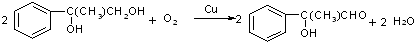
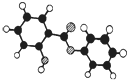 萨罗(Salol)是一种消毒剂,为芳香族化合物,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).则下列说法不正确的是( )
萨罗(Salol)是一种消毒剂,为芳香族化合物,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).则下列说法不正确的是( )| A. | 萨罗的分子式为C13H10O3 | |
| B. | 1mol萨罗与浓溴水反应,需要消耗3mol Br2 | |
| C. | 1mol萨罗发生水解,需要消耗3mol NaOH | |
| D. | 萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸) |
| A. | 5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA | |
| B. | 1.8g重水(D2O)中含有的质子数和电子数均为1.0NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA | |
| D. | 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |

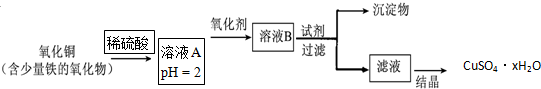
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2和石墨粉等物质.请回答以下问题:
(1)操作②玻璃棒的作用是引流;操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、泥三角、坩埚 和三脚架;
(2)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为C(填化学式).
(3)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为MnO2(填化学式).
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
| 实验目的 | 操作 | 实验现象 | 结论 |
| 1检验Cl- | 取少许滤液于试管中,加入硝酸酸化的硝酸银溶液 | 有白色沉淀产生 | 含有Cl- |
| 2检验NH4+ | 取少许滤液于试管中,加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近 | 石蕊试纸变蓝色 | 含有NH4+ |

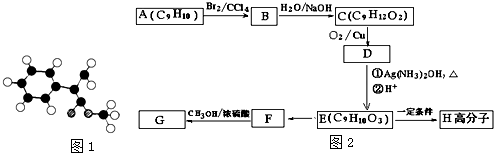
 ;
;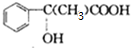 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +(n-1)H2O.
+(n-1)H2O.