题目内容
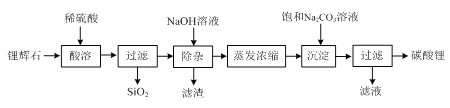
【题目】辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质.研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜。主要工艺流程如下:
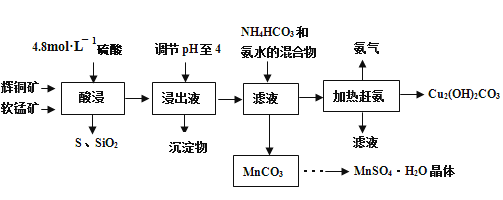
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4
④MnSO4·H2O溶于1份冷水、0.6份沸水,不溶于乙醇。
(1)实验室配制250mL 4.8molL-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要________________________。
(2)酸浸时,为了提高浸取率可采取的措施有_____________________(任写一点)。
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式:__________。
(4)调节浸出液pH=4的作用是______________。
(5)本工艺中可循环使用的物质是____________(写化学式)。
(6)获得的MnSO4H2O晶体需要进一步洗涤、干燥,洗涤时应用_____________洗涤。
(7)测定MnSO4H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为________________。
【答案】250mL容量瓶 胶头滴管 粉碎矿石(或加热或者搅拌)(任写一点) Cu2S+2MnO2+4H2SO4=2CuSO4+2MnSO4+S↓+4H2O 使Fe3+完全水解生成氢氧化铁沉淀 NH3 酒精 96.57%
【解析】
酸浸过程中,二氧化硅不反应,分离出来,Cu2S反应生成S单质,Fe2O3溶解成溶液,PH值控制在4时,Fe3+沉淀,过滤得到的滤液成分应为CuSO4和MnSO4等,加热赶氢过后,得到碱式碳酸铜,滤渣为碳酸锰,通过蒸发浓缩、冷却结晶、过滤洗涤等操作即可得到硫酸锰晶体。
(1)实验室配置250mL 4.8molL-1的溶液需要250mL的容量瓶和胶头滴管;
(2)为了提高浸取率可采取的措施可以粉碎矿石增大接触面积、加热、搅拌等。
(3)有题目可知,MnO2具有氧化性,且Cu2S与MnO2在H2SO4浸泡的条件下生成了S,CuSO4和MnSO4,故根据氧化还原反应配平,可得到Cu2S+2MnO2+4H2SO4=2CuSO4+2MnSO4+S↓+4H2O;
(4)根据提示Fe3+的PH沉淀范围:1.5~3.2可知当PH=4时,Fe3+会水解生成氢氧化铁沉淀;
(5)本流程中NH4HCO3分解生成NH3,NH3可循环使用;
(6)由于MnSO4·H2O不溶于乙醇,故使用乙醇洗涤可以促进晶体形成;
(7)根据提示n(BaSO4)=n(SO42-)=n(MnSO4·H2O)=![]() =0.02mol,25mL 溶液中含有n(SO42-)=n(MnSO4·H2O)=0.02mol,故100mL溶液含有n(MnSO4·H2O)=0.08mol,m(MnSO4·H2O)=
=0.02mol,25mL 溶液中含有n(SO42-)=n(MnSO4·H2O)=0.02mol,故100mL溶液含有n(MnSO4·H2O)=0.08mol,m(MnSO4·H2O)=![]() =13.52g,那么样品的纯度为
=13.52g,那么样品的纯度为![]() =96.57%
=96.57%

 阅读快车系列答案
阅读快车系列答案【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以硫酸渣制备铁红(Fe2O3),过程如下:
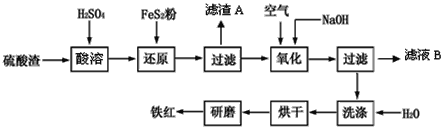
(1)酸溶过程中Fe2O3与稀硫酸反应的离子方程式是____。
(2)还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:_____。
(3)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是__。
(部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(二)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
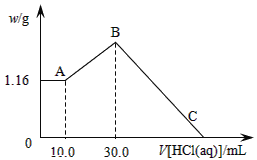
(1)原混合物中NaOH的质量是____g。
(2)C点(此时沉淀恰好完全溶解)HCl溶液的体积为___mL。
(三)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过如图1过程制备ClO2:
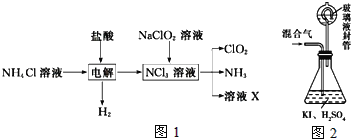
用如图2装置可以测定混合气中ClO2的含量:
Ⅰ、在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ、在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ、将一定量的混合气体通入锥形瓶中吸收;
Ⅳ、将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ、用0.1000molL1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-═2I+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①测得混合气中ClO2的质量为___g。
②用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是___(填标号).
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
【题目】用分液漏斗向锥形瓶中滴加液体至过量,下列对锥形瓶中现象的预测符合实际情况的是
选项 | 锥形瓶 | 分液漏斗 | 预测现象 |
A | 酸性KMnO4溶液 | H2O2溶液 | 溶液紫红色逐渐褪去且产生大量气泡 |
B | Na2S溶液 | 久置氯水 | 生成淡黄色沉淀 |
C | Fe(OH)3胶体 | 盐酸 | 产生红褐色沉淀 |
D | Na2CO3溶液 | H2BO3溶液 | 产生大量气泡 |
A. AB. BC. CD. D