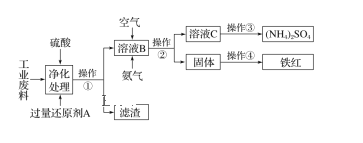
题目内容
【题目】向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
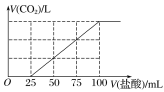
下列判断正确的是( )
A.所得溶液的溶质成分为NaOH和Na2CO3
B.所得溶液的溶质成分为NaHCO3和Na2CO3
C.原NaOH溶液的浓度为0.1mol·L-1
D.通入CO2在标准状况下的体积为448mL
【答案】B
【解析】
假设NaOH与CO2气体反应所得溶液中只有Na2CO3,则开始阶段发生反应:Na2CO3+HCl=NaHCO3+NaCl,生成CO2发生的反应为:NaHCO3+HCl=NaCl+CO2↑+H2O,由方程式可知,前后两个阶段消耗盐酸的体积应相等,而实际生成二氧化碳消耗的盐酸体积多,故NaOH与CO2气体反应所得溶液中溶质为Na2CO3、NaHCO3。
A.根据分析可知所得溶液的溶质成分为NaHCO3和Na2CO3,故A错误;
B.根据分析可知所得溶液的溶质成分为NaHCO3和Na2CO3,故B正确;
C.滴加100mL盐酸时,碳元素全部转化为二氧化碳,溶液中的溶质只有NaCl,所以n(Na+)= n(Cl-)=0.1L×0.2mol·L-1=0.02mol,所以n(NaOH)=0.02mol,c(NaOH)=0.02mol÷0.1L=0.2mol/L,故C错误;
D.由曲线可知从25mL到100mL为碳酸氢钠与盐酸反应生成二氧化碳,反应方程式为:NaHCO3+HCl=NaCl+CO2↑+H2O,所以n(CO2)=n(HCl)=(0.1L-0.025L)×0.2mol/L=0.015mol,所以CO2气体体积为0.015mol×22.4L/mol=0.336L=336mL,故D错误;
故答案为B。

【题目】某学生为探究锌与盐酸反应过程中的速率变化,在![]() 时,向100 mL 2 mol·L-1盐酸中加入过量的锌粉,测得氢气体积(已换算成标准状况)累计值如下:
时,向100 mL 2 mol·L-1盐酸中加入过量的锌粉,测得氢气体积(已换算成标准状况)累计值如下:
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)①在2~3 min时间段内,用盐酸的浓度变化表示的反应速率为_______.
②在0~5min内,反应速率最大的时间段是___(填 “1~2 min”、“2~3 min”或“3~4 min”)。
(2)若完全反应后放出15.2 kJ的热量,则反应Zn(s) + 2HCl(aq)=ZnCl2(aq) + H2(g)的△H=____
(3)为了减缓反应速率但不减少产生气体的量,可向反应物中分别加入等体积的下列液体,你认为可行的是_______(填字母)。
a. 蒸馏水 b. Na2CO3溶液 c. NaNO3溶液
(4)为了加快反应速率但不减少产生气体的量,某同学向反应物中加入了少量CuSO4固体,该同学操作____(填 “合理”或“不合理”),理由是_______