题目内容
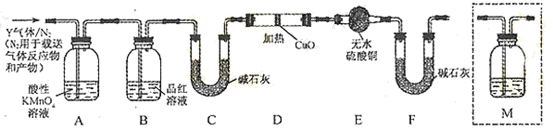
(14分)化学上常用燃烧法确定有机物的组成.下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品.根据产物的质量确定有机物的组成

回答下列问题:
(1)A装置中分液漏斗盛放的物质是______________,写出有关反应的化学方程式______________________________________________________________.
(2)C装置(燃烧管)中CuO的作用是______________________________________
(3)写出E装置中所盛放试剂的名称__________,它的作用是______________.
(4)若将B装置去掉会对实验造成什么影响? __________________________.
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种).经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为____.
(1)H2O2(或双氧水) 2H2O2  2H2O+O2↑
2H2O+O2↑
(或H2O 2Na2O2+2H2O===4NaOH+O2↑)
(2)使有机物充分氧化生成CO2和H2O
(3)碱石灰或氢氧化钠 吸收CO2
(4)造成测得有机物中含氢量增大
(5)CH2O
【解析】考查有机物分子式的确定。
A装置是生成氧气的,因为反应不需要加热,所以可利用二氧化锰的催化作用使双氧水分解产生氧气(或者利用过氧化钠和水生成氧气)。由于参与反应的氧气必须是纯净干燥的,所以需要对生成的氧气进行净化处理,用浓硫酸干燥氧气,然后和有机物反应。如果不进行干燥,生成的氧气直接和有机物反应,则测得的水的质量偏大,即有机物中氢的含量偏高。有机物的燃烧产物首先应该是用无水氯化钙来吸收生成的水,然后再用碱石灰或氢氧化钠吸收生成的CO2;有机物在燃烧过程中也可能燃烧不充分,从而生成CO,因此需要用氧化铜来氧化可能生成的CO;E管质量增加1.76 g,则CO2的物质的量是 。D管质量增加0.72 g,则水的物质的量是
。D管质量增加0.72 g,则水的物质的量是
 。所以有机物中氧原子的质量是1.20g-0.04mol×12g/mol-0.08mol×1g/mol=0.64g,物质的量是
。所以有机物中氧原子的质量是1.20g-0.04mol×12g/mol-0.08mol×1g/mol=0.64g,物质的量是 =0.04mol,所以有机物中C、H、O的个数之比是1︰2︰1,因此最简式是CH2O。
=0.04mol,所以有机物中C、H、O的个数之比是1︰2︰1,因此最简式是CH2O。