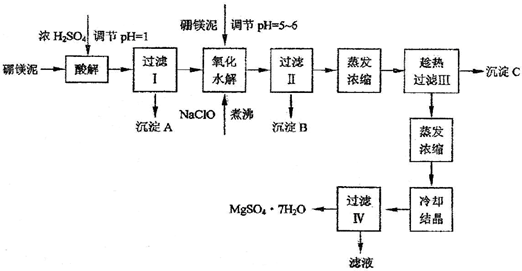
题目内容
检验溶液中的Cl-需注意什么问题?
答案:
解析:
解析:
|
(1)一般先在被测液中加入稀硝酸酸化,以排除干扰离子.因为:加入AgNO3溶液,Ag++Cl-AgCl↓(白色),AgCl沉淀是不溶于稀硝酸的,若在Na2CO3溶液中加入AgNO3溶液也会产生白色的Ag2CO3沉淀,此沉淀可溶于稀硝酸.2Ag++ (2)若被检液中有 |

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目