题目内容
17.假如规定质量数为12的碳原子(12C)的相对原子质量为24,并用以确定相对原子质量,以0.024kg 12C所含的原子数为阿伏加德罗常数,下列数值:①浓H2SO4的物质的量浓度;
②O2的溶解度;
③气体摩尔体积;
④阿伏加德罗常数;
⑤氧元素的相对原子质量;
⑥32gO2在标况下的体积.
其中变成原来2倍的是( )
| A. | ①②⑥ | B. | ②⑥ | C. | ③④⑤ | D. | ③④ |
分析 假设12C的相对原子质量为24,且以0.024 千克12C所含有的原子数为阿伏加德罗常数,则在规定12C的相对原子质量为24时,实际上是把作为相对原子质量的标准从原来用12C质量的$\frac{1}{12}$改为$\frac{1}{24}$,但是单个碳原子的质量并没有因此而发生改变;原来是以0.012kg12C所含有的碳原子数作为阿伏加德罗常数(即6.02×1023),现在用0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),很明显0.024kg12C中所含的原子个数是0.012kg12C中所含的原子个数的2倍;故阿伏加德罗常数(NA)变为原来阿伏加德罗常数的2倍(即2×6.02×1023),以此进行解答.
解答 解:①阿伏加德罗常数(NA)变为原来阿伏加德罗常数的2倍,浓硫酸的物质的量浓度变为原来$\frac{1}{2}$倍,故①错误;
②阿伏加德罗常数(NA)变为原来阿伏加德罗常数的2倍,但氧气的溶解度不会变化,故②错误;
③阿伏伽德罗常数变为原来的2倍,则每摩尔气体含有的分子数目为原来的2倍,一定条件下占有的体积为原来的2倍,故③正确;
④把作为相对原子质量的标准从原来用12C质量的$\frac{1}{12}$改为$\frac{1}{24}$,但是单个碳原子的质量并没有因此而发生改变,原来是以0.012kg12C所含有的碳原子数作为阿伏加德罗常数(即6.02×1023),现在用0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),很明显0.024kg12C中所含的原子个数是0.012kg12C中所含的原子个数的2倍,故阿伏加德罗常数(NA)变为原来阿伏加德罗常数的2倍(即2×6.02×1023),故④正确;
⑤氧原子质量不变,但标准却由12C质量的$\frac{1}{12}$改为$\frac{1}{24}$,所以氧元素的相对原子质量由16变为32,即氧元素的相对原子量变为原来的2倍,故⑤正确;
⑥32g氧气含有的氧气的分子数不变,则占有的体积不变,故⑥错误;
故选C.
点评 本题考查了物质的量与浓度、气体摩尔体积等物理量之间的关系,题目难度中等,明确物质的量与摩尔质量、阿伏伽德罗常数等物理量之间的关系为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.

| A. | HR | B. | H2R | C. | RH3 | D. | RH4 |
| 化学键 | A-A | B-B | A-B |
| 生成1mol化学键时放出的能量 | 436kJ•mol-1 | 243kJ•mol-1 | 431kJ•mol-1 |
| A. | $\frac{1}{2}$A2(g)+$\frac{1}{2}$B2(g)═AB(g)△H=-91.5 kJ•mol -1 | |
| B. | A2(g)+B2(g)═2AB(g)△H=-183 kJ•mol -1 | |
| C. | $\frac{1}{2}$A2(g)+$\frac{1}{2}$B2═AB(g)△H=+91.5 kJ•mol-1 | |
| D. | 2AB(g)═A2(g)+B2(g)△H=+183 kJ•mol-1 |
| A. | 消耗相同浓度的盐酸一样多 | |
| B. | 消耗同浓度的盐酸后者多 | |
| C. | 与盐酸反应后相同条件下收集的气体一样多(不包括加热生成的) | |
| D. | 与盐酸反应后相同条件下收集的气体后者多.(不包括加热生成的) |
(1)将水蒸气通过红热的碳即可产生水煤气.
反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1;
①该反应在高温下能自发进行(填“能”或“不能”);
②恒温下,在容积不变的密闭容器中,进行如上可逆反应.一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有:D.
Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量;ⅣCO物质的量浓度
A、只有ⅣB、只有Ⅰ和ⅣC、只有Ⅱ和ⅢD、Ⅰ、Ⅱ、Ⅲ和Ⅳ
(2)水煤气再进一步反应可制取氢气.反应为H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=4/9.该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是C.
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
B、平衡时,甲中和丙中H2的转化率均是60%
C、平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D、平衡时,乙中CO2的转化率大于60%
| A. | MnO4-→MnO2 | B. | Cl2→HClO | C. | Fe2+→Fe3+ | D. | HCO3-→CO${\;}_{3}^{2-}$ |

 .
. .
. .
. 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH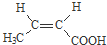 .
. .
.

 ;
; ;
; 、
、 .
.