题目内容
【题目】实验室从含碘废液![]() 除
除![]() 外,含有
外,含有![]() 、
、![]() 、
、![]() 等
等![]() 中回收碘,其实验过程如图1:
中回收碘,其实验过程如图1:
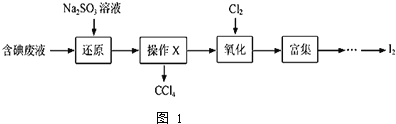
![]() 向含碘废液中加入稍过量的
向含碘废液中加入稍过量的![]() 溶液,将废液中的
溶液,将废液中的![]() 还原为
还原为![]() ,其离子方程式为 ______ ;该操作将
,其离子方程式为 ______ ;该操作将![]() 还原为
还原为![]() 的目的是 ______ .
的目的是 ______ .
![]() 操作X的名称为 ______ .
操作X的名称为 ______ .
![]() 氧化时,在三颈瓶中将含
氧化时,在三颈瓶中将含![]() 的水溶液用盐酸调至pH约为2,缓慢通入
的水溶液用盐酸调至pH约为2,缓慢通入![]() ,在
,在![]() 左右反应
左右反应![]() 实验装置如图2所示
实验装置如图2所示![]() 实验控制在较低温度下进行的原因是 ______ ;锥形瓶里盛放的溶液为 ______ .
实验控制在较低温度下进行的原因是 ______ ;锥形瓶里盛放的溶液为 ______ .
![]() 利用如图3所示装置
利用如图3所示装置![]() 电极均为惰性电极
电极均为惰性电极![]() 也可吸收
也可吸收![]() ,并用阴极排出的溶液吸收
,并用阴极排出的溶液吸收![]() .
.
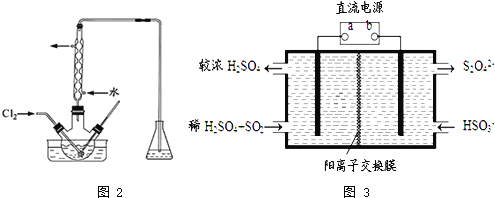
![]() 为电源的 ______
为电源的 ______ ![]() 填“正极”或“负极”
填“正极”或“负极”![]() ,阳极的电极反应式为 ______ .
,阳极的电极反应式为 ______ .
![]() 在碱性条件下,用阴极排出的溶液吸收
在碱性条件下,用阴极排出的溶液吸收![]() ,使其转化为无害气体,同时有
,使其转化为无害气体,同时有![]() 生成.该反应中氧化剂与还原剂的物质的量之比为 ______ .
生成.该反应中氧化剂与还原剂的物质的量之比为 ______ .
【答案】![]() 使
使![]() 中的碘进入水层 分液 使氯气在溶液中有较大的溶解度
中的碘进入水层 分液 使氯气在溶液中有较大的溶解度![]() 或防止
或防止![]() 升华或防止
升华或防止![]() 进一步被氧化
进一步被氧化![]() NaOH溶液 正极
NaOH溶液 正极 ![]() 1:2
1:2
【解析】
碘废液加亚硫酸钠溶液,把单质碘还原为![]() ,四氯化碳难溶于水,会分层,则分液即可得到四氯化碳,剩余的溶液中加氯气氧化
,四氯化碳难溶于水,会分层,则分液即可得到四氯化碳,剩余的溶液中加氯气氧化![]() 得到
得到![]() ,富集,最后得到较纯的
,富集,最后得到较纯的![]() ,
,
![]() 碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘;碘微溶于水,而碘离子易溶于水;
碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘;碘微溶于水,而碘离子易溶于水;
![]() 分离互不相溶的液体采用分液的方法分离,四氯化碳属于有机物,水属于无机物,二者不互溶;
分离互不相溶的液体采用分液的方法分离,四氯化碳属于有机物,水属于无机物,二者不互溶;
![]() 碘易升华,且氯气的溶解度随着温度的升高而减小;氯气、碘蒸气都能和氢氧化钠溶液反应生成无毒物质;
碘易升华,且氯气的溶解度随着温度的升高而减小;氯气、碘蒸气都能和氢氧化钠溶液反应生成无毒物质;
![]() 根据电解池中阳极发生氧化反应,与电源正极相连的为阳极可以判断
根据电解池中阳极发生氧化反应,与电源正极相连的为阳极可以判断![]() 图中a极要连接电源的正极;依据电极原理和反应过程中的离子变化写出电极反应;
图中a极要连接电源的正极;依据电极原理和反应过程中的离子变化写出电极反应;
![]() 二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,a为正电源极,b为电源负极,依据在碱性条件下,阴极排出的溶液为
二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,a为正电源极,b为电源负极,依据在碱性条件下,阴极排出的溶液为![]() ,二氧化氮与其发生反应
,二氧化氮与其发生反应![]() ,依据方程式即可解答。
,依据方程式即可解答。
![]() 碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘离子,离子反应方程式为
碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘离子,离子反应方程式为![]() ;碘微溶于水,而碘离子易溶于水,为了使更多的I元素进入水溶液应将碘还原为碘离子; 故答案为:
;碘微溶于水,而碘离子易溶于水,为了使更多的I元素进入水溶液应将碘还原为碘离子; 故答案为:![]() ;使
;使![]() 中的碘进入水层;
中的碘进入水层;
![]() 四氯化碳属于有机物,水属于无机物,者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法;故答案为:分液;
四氯化碳属于有机物,水属于无机物,者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法;故答案为:分液;
![]() 碘易升华,且氯气的溶解度随着温度的升高而减小,温度越高,氯气的溶解度越小,反应越不充分,所以应该在低温条件下进行反应;氯气、碘蒸气都有毒,不能直接排空,且都能和氢氧化钠溶液反应生成无毒物质,所以用NaOH溶液吸收氯气和碘蒸气;故答案为:使氯气在溶液中有较大的溶解度
碘易升华,且氯气的溶解度随着温度的升高而减小,温度越高,氯气的溶解度越小,反应越不充分,所以应该在低温条件下进行反应;氯气、碘蒸气都有毒,不能直接排空,且都能和氢氧化钠溶液反应生成无毒物质,所以用NaOH溶液吸收氯气和碘蒸气;故答案为:使氯气在溶液中有较大的溶解度![]() 或防止碘升华或防止碘进一步被氧化
或防止碘升华或防止碘进一步被氧化![]() ;NaOH溶液;
;NaOH溶液;
![]() 依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,a为正电源极,b为电源负极;阳极区发生反应
依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,a为正电源极,b为电源负极;阳极区发生反应![]() ,故答案为:正极;
,故答案为:正极;![]() ;
;
![]() 阴极排出的溶液为
阴极排出的溶液为![]() ,二氧化氮与其发生反应,
,二氧化氮与其发生反应,![]() 中硫元素由
中硫元素由![]() 价,变为亚硫酸根中硫元素为
价,变为亚硫酸根中硫元素为![]() 价,
价,![]() 被氧化是还原剂;二氧化氮中的氮元素化合价为
被氧化是还原剂;二氧化氮中的氮元素化合价为![]() 价变为氮气0价,二氧化氮被还原为氧化剂,依据原子守恒和得失电子守恒可得,发生的离子方程式为
价变为氮气0价,二氧化氮被还原为氧化剂,依据原子守恒和得失电子守恒可得,发生的离子方程式为![]() ,所以该反应中氧化剂与还原剂的物质的量之比为1:2,故答案为:1:2。
,所以该反应中氧化剂与还原剂的物质的量之比为1:2,故答案为:1:2。

 名校课堂系列答案
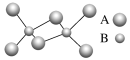
名校课堂系列答案【题目】(1)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。

参数 分子 | 分子直径/nm | 分子与H2O的结合能E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中分子间存在的两种作用力是_____________________________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是_____。
(2) H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为____________。