题目内容
【题目】重铬酸钾(K2Cr2O7)主要用于制革、印染、电镀等.其水溶液中存在平衡:Cr2O72﹣+H2O2CrO42﹣+2H+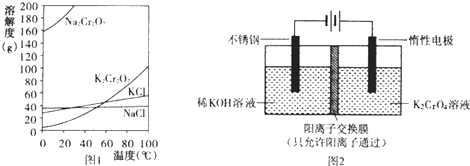
(1)已知有关物质溶解度如图1.用复分解法制备K2Cr2O7的操作过程是:向Na2Cr2O7溶液中加入(填化学式),搅拌溶解,调节溶液pH约为5,加热溶液至表面有少量晶体析出时, , 抽滤得到粗产品,再用重结晶法提纯粗产品.
(2)以铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾的实验装置如图2.
①不锈钢作极,写出该电极的电极反应式 .
②分析阳极区能得到重铬酸钾溶液的原因 .
③当铬酸钾的转化率达到x时,阳极液中K与Cr的物质的量之比为
(3)铬对环境能造成污染.某酸性废水中含有Cr2O72﹣ , 处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72﹣转化为毒性较低的Cr3+ , 再调节pH约为8,使铬元素沉降,分离出污泥后检测废水中Cr3+浓度,低于0.5mgL﹣1则达到排放标准.
①Na2S2O5参加反应的离子方程式为 .
②经上述工艺处理后的废水,理论上Cr3+浓度约为 mgL﹣1 .
(已知室温下Ksp[Cr(OH)3]≈6×10﹣31)
【答案】
(1)KCl;冷却结晶
(2)阴;2H2O+2e﹣=2OH﹣+H2↑;阳极OH﹣放电,溶液中H+浓度增大,使Cr2O72﹣+H2O?2CrO42﹣+2H+向生成Cr2O72﹣方向移动,部分K+通过阳离子交换膜移动到阴极区,使阳极区主要成分是K2Cr2O7;2:(1﹣0.5x)
(3)3S2O52﹣+2Cr2O72﹣+10H+=6SO42﹣+4Cr3++5H2O;3×10﹣8
【解析】解:(1)由图可知Na2Cr2O7的溶解度较大,K2Cr2O7的溶解度较小,Na2Cr2O7水溶液中加KCl,加热浓缩、冷却结晶,可得到K2Cr2O7;
所以答案是:KCl;冷却结晶;(2)①与电源的负极相连作阴极;阴极上氢离子得电子生成氢气,则阴极的电极方程式为:2H2O+2e﹣=2OH﹣+H2↑;
所以答案是:阴;2H2O+2e﹣=2OH﹣+H2↑;
②阳极上溶液中阴离子放电,氢氧根离子失电子发生氧化反应,氢离子浓度增大使Cr2O72﹣+H2O2CrO42﹣+2H+向生成Cr2O72﹣方向移动;
所以答案是:阳极OH﹣放电,溶液中H+浓度增大,使Cr2O72﹣+H2O2CrO42﹣+2H+向生成Cr2O72﹣方向移动,部分K+通过阳离子交换膜移动到阴极区,使阳极区主要成分是K2Cr2O7;
③设K2CrO4为1mol,则K+为2mol,铬酸钾的转化率达到x,则生成为K2Cr2O70.5xmol,K2CrO4剩余为1﹣xmol,
则阳极液中K与Cr的物质的量之比为2:(1﹣x+0.5x)=2:(1﹣0.5x);
所以答案是:2:(1﹣0.5x);(3)①焦亚硫酸钠(Na2S2O5)将Cr2O72﹣转化为毒性较低的Cr3+ , 同时焦亚硫酸钠被氧化为硫酸钠,其反应的离子方程式为:3S2O52﹣+2Cr2O72﹣+10H+=6SO42﹣+4Cr3++5H2O;
所以答案是:3S2O52﹣+2Cr2O72﹣+10H+=6SO42﹣+4Cr3++5H2O;
②pH约为8,则c(OH﹣)=10﹣6mol/L,已知Ksp[Cr(OH)3]≈6×10﹣31 , c(Cr3+)= ![]() =6×10﹣13mol/L,则1L溶液中Cr元素的质量为6×10﹣13mol×52g/mol=3.126×10﹣11g≈3×10﹣8mg,则理论上Cr3+浓度约为3×10﹣8mg/L;
=6×10﹣13mol/L,则1L溶液中Cr元素的质量为6×10﹣13mol×52g/mol=3.126×10﹣11g≈3×10﹣8mg,则理论上Cr3+浓度约为3×10﹣8mg/L;
所以答案是:3×10﹣8 .

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】乙苯催化脱氢生产苯乙烯的反应:![]()
(1)一定温度下,将amol乙苯加入体积为VL的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如下表.
时间/min | 0 | 10 | 20 | 30 | 40 |
总压强/1000kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
①平衡时,容器中气体物质的量总和为 mol,乙苯的转化率为
②列式计算此温度下该反应的平衡常数K
(2)根据化学反应原理,分析减小压强对该反应的影响
(3)实际生产的反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比对乙苯转化率的影响可用图表示.[M=n(H2O)/n(乙苯]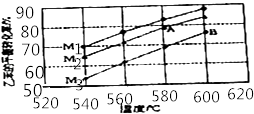
比较图中A,B两点对应平衡常数大小:KAKB
②图中投料比(M1、M2、M3)的大小顺序为
③随着反应的进行,催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是(用化学方程式表示)
