题目内容
硫酸铁和硫酸亚铁的混合物中,若其中铁元素的质量分数为a%,则其中硫元素的质量分数为( )
| A、(100-3a)% | ||
B、
| ||
C、
| ||
D、
|
考点:元素质量分数的计算
专题:计算题
分析:根据由于混合物是由Fe2(SO4)3和FeSO4组成的,共含铁、硫、氧三种元素组成,而每有1个S,就有4个O,所以若铁元素的质量分数为a%,则两种元素的质量分数和是1-a%,则可求出硫元素.
解答:
解:硫酸铁[Fe2(SO4)3]和硫酸亚铁[FeSO4]均由Fe、S、O三种元素组成,因此其混合物中Fe%+S%+O%=100%,现已知铁元素的质量分数为a%,则两种元素的质量分数和是1-a%.经仔细分析,这两种化合物中S、O原子个数比相同,都为1:4,所以它们的质量比也成恒比,即为:32:64=1:2,所以硫元素的质量分数为:(1-a%)×
=
%;
故选:B.
| 1 |
| 3 |
| 100-a |
| 3 |
故选:B.
点评:根据混合物组成中两化合物的中组成元素的质量特别关系,确定混合物中元素的质量分数,此类问题通常存在这种特点.

练习册系列答案
相关题目
气体X可能由NH3、Cl2、HBr、CO2中的一种或几种组成,已知X通入AgNO3溶液时产生浅黄色沉淀,该沉淀不溶于稀HNO3,若将X通入澄清石灰水中,无沉淀产生,则有关气体X的成分的下列说法正确的是( )
①一定含有HBr,可能含有CO2 ②一定不含CO2 ③一定不含NH3、Cl2 ④可能含有Cl2、CO2.
①一定含有HBr,可能含有CO2 ②一定不含CO2 ③一定不含NH3、Cl2 ④可能含有Cl2、CO2.
| A、只有① | B、只有③ |
| C、①和③ | D、②和③ |
下列有关叙述正确的是( )
| A、苯分子是碳碳单双键交替相连的结构,因此苯环上碳碳键的键长都不相等 |
| B、甲烷分子是以碳原子为中心的四面体结构,CCl4却不是正四面体结构 |
C、 属于脂环化合物 属于脂环化合物 |
| D、苯是一种无色液体,难溶于水,密度比水小 |
硅及其化合物在材料领域中应用广泛,下列叙述错误的是( )
| A、石英(SiO2)是制造玻璃的重要原料之一 |
| B、石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料 |
| C、Na2SiO3是制备硅胶和木材防火剂的原料 |
| D、晶体硅是制造光导纤维的材料 |
2012年3月新修订的《环境空气质量标准》增设了PM2.5(直径小于或等于2.5微米的颗粒物)浓度限值、臭氧8小时平均浓度限值.下列有关说法正确的是( )
| A、PM2.5所指颗粒物大小与胶体中分散质粒子大小相当 |
| B、O2和O3互为同素异形体,两者的化学性质相同 |
| C、O3转化为O2和O2转化为O3过程中均有能量变化 |
| D、反应3O2=2O3有单质参加,属于氧化还原反应 |
下列离子方程式书写正确的是( )
| A、NaHCO3溶液中加入NaOH 溶液:HCO3-+OH-═CO2↑+H2O |
| B、在NaOH溶液中滴入少量AlCl3溶液:Al3++3OH-═Al(OH)3↓ |
| C、甲酸溶液中滴入NaOH溶液:HCOOH+OH-═HCOO-+H2O |
| D、CO2通入CaCl2溶液:CO2+H2O+Ca2+═CaCO3↓+2H+ |
五种短周期元素的原子半径及主要化合价如下,下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、R的氧化物及其对应的水化物均具有两性 |
| B、L、M的单质均用电解其熔融盐的方法冶炼 |
| C、T的氢化物还原性及稳定性均比Q的氢化物强 |
| D、五种元素的常见简单离子中半径最大的是Q2- |
下面是一种三肽,它可以看作是3个氨基酸缩合而得到的产物
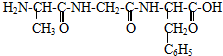
现有一个多肽分子,分子式为CXHYN12OD(X,Y,D为自然数)将它完全水解后只得到下列三种氨基酸
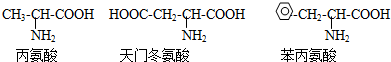
现将一个该多肽分子水解后,得到天门冬氨酸的分子个数为( )
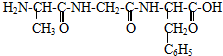
现有一个多肽分子,分子式为CXHYN12OD(X,Y,D为自然数)将它完全水解后只得到下列三种氨基酸
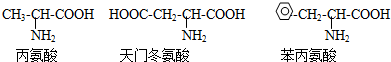
现将一个该多肽分子水解后,得到天门冬氨酸的分子个数为( )
| A、D-12 | ||
| B、D-13 | ||
C、
| ||
D、
|