题目内容
5.分析下列反应的化学方程式,是氧化还原反应的用线桥法标出电子转移的方向和数目(1)BaCl2+Na2SO4═BaSO4↓+2NaCl不是氧化还原反应
(2)Fe+2HCl═FeCl2+H2↑
 .
.
分析 (1)反应中元素化合价不变,不属于氧化还原反应;
(2)中Fe元素化合价由0价变为+2价、H元素化合价由+1价变为0价,所以属于氧化还原反应,转移电子数为2.
解答 解:(1)BaCl2+Na2SO4═BaSO4↓+2NaCl反应中各元素化合价不变,不属于氧化还原反应,属于复分解反应;
故答案为:不是氧化还原反应;
(2)Fe+2HCl═FeCl2+H2↑中Fe元素化合价由0价变为+2价、H元素化合价由+1价变为0价,所以属于氧化还原反应,转移电子数为2,转移电子方向和数目为 ,
,
故答案为: .
.
点评 本题考查氧化还原反应判断、电子转移方向和数目的书写,侧重考查基本概念,熟悉常见元素化合价变化,知道氧化还原反应本质和特征的区别.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
16. 如图表示反应X(g)?4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )
如图表示反应X(g)?4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )
 如图表示反应X(g)?4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )
如图表示反应X(g)?4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )| A. | X的平衡转化率为85% | |
| B. | 第6 min 后,反应就终止了 | |
| C. | 若升高温度,X的平衡转化率将大于85% | |
| D. | 若降低温度,v正减小,v逆增大 |
14.原子序数依次增大的X、Y、Z、M、W为五种短周期元素.已知Y与Z、M与W分别同周期,X与M同主族;X、Z、M的质子数之和等于Y、W的质子数之和;X与Z、M与Z都可以分别形成A2B、A2B2型的化合物;X与Y形成的气态化合物在标准状况下的相对分子质量为17;Y、M、W的最高价氧化物的水化物,两两间都能发生反应.下列说法正确的是( )
| A. | M的单质可用于从钛、锆等金属的氯化物溶液中置换出钛、锆等单质 | |
| B. | 由X、Y、Z三种元素形成的某种化合物的水溶液,可能呈碱性或酸性 | |
| C. | 由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同 | |
| D. | 含有W阳离子的某种盐,可用作净水剂 |
 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.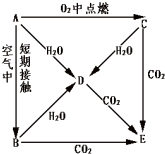 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,己知A金属为单质.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,己知A金属为单质.