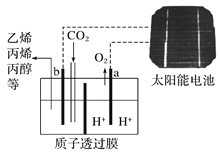
题目内容
【题目】用一无色透明的溶液做如下实验:
①取少量溶液滴加盐酸酸化的BaCl2溶液,有白色沉淀生成。
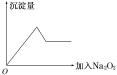
②另取部分溶液加入Na2O2,有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成沉淀的量的关系如图所示:
试问:Cu2+、NH![]() 、Al3+、Mg2+、Na+、Fe3+、CO
、Al3+、Mg2+、Na+、Fe3+、CO![]() 、K+、SO
、K+、SO![]() 等离子中一定存在的离子是________;可能存在的离子是________;一定不存在的离子是________。
等离子中一定存在的离子是________;可能存在的离子是________;一定不存在的离子是________。
【答案】SO42-、Al3+、Mg2+Na+、K+NH4+、Cu2+、Fe3+、CO32-
【解析】
因是“无色透明溶液”,该溶液中不能含有有色的Cu2+、Fe3+,根据“取少量溶液滴加盐酸酸化的BaCl2溶液有白色沉淀生成”可以知道溶液中含有SO42-;一定不含有CO32-,因为碳酸钡溶于盐酸;向溶液中加入过氧化钠,产生无色无味气体,说明该溶液中不含NH4+,因为若有NH4+,会与过氧化钠与水反应生成的氢氧化钠反应生成氨气,氨气具有刺激性气味;当向溶液中加入过氧化钠时,会生成白色沉淀,且沉淀量先增加后减少,但不会完全消失,说明溶液中含有Al3+、Mg2+ ,因为沉淀达到最大量后,加入过量的过氧化钠后沉淀立刻溶解,则溶液中一定不存在NH4+;因此该溶液中一定存在的离子为: SO42-、Al3+、Mg2+;可能含有Na+、K+;一定不存在的离子为NH4+、Cu2+、Fe3+、CO32-。综上所述,本题答案是:SO42-、Al3+、Mg2+ ; Na+、K+;NH4+、Cu2+、Fe3+、CO32-。

【题目】短周期五种元素A、B、C、D、E的原子序数依次增大。A、B、C的单质在常温下都呈气态,C原子最外层电子数是电子层数的3倍,C和E位于同主族。1 mol DAx与足量的A2C反应生成44.8 L(标准状况)G气体。A、B的单质依次为G、T,在密闭容器中充入一定量的G、T,一定条件下发生反应G+T→W(未配平),测得各物质的浓度如表所示。
物质 | T | G | W |
10 min时,c/(mol/L) | 0.5 | 0.8 | 0.2 |
20 min时,c/(mol/L) | 0.3 | 0.2 | 0.6 |
回答下列问题:
(1)A、B、C能组成既含离子键又含共价键的化合物,该化合物的化学式为_________。
(2)B、C、D、E的简单离子中,离子半径由大到小排序为__________(用离子符号表示)。
(3)J、L是由A、B、C、E四种元素组成的两种常见酸式盐,J、L混合可产生有刺激性气味的气体,写出这两种溶液发生反应的离子方程式__________;J、L中能使酸性高锰酸钾溶液褪色的是_______(填化学式)。
(4)B2A4C2碱性燃料电池放电效率高。该电池放电时生成B2和A2C,正极反应式为________;电池工作一段时间后,电解质溶液的pH_____(填“增大”“减小”或“不变”)。
(5)由A、B、C、D四种元素组成的单质、化合物在一定条件下的转化关系(部分条件和产物已省略)如图所示,已知M耐高温。
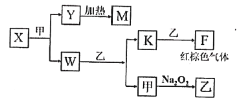
①X的电子式为______。
②已知W与乙反应生成K和甲是某重要化工生产步骤之一,提高其反应速率的方法除增大反应物浓度、增大压强外,还有______、______。