题目内容
取2a L醋酸和a L盐酸分别与b L物质的量浓度为c mol?L-1的氢氧化钠溶液混合,都恰好完全中和,则下列说法中正确的是( )
分析:2a L醋酸和a L盐酸分别与b L物质的量浓度为c mol?L-1的氢氧化钠溶液混合,都恰好完全中和,说明酸和碱的物质的量相等.
A、盐的类型不同导致盐溶液的酸碱性不同.
B、弱电解质部分电离.
C、2a L醋酸和a L盐酸分别与b L物质的量浓度为c mol?L-1的氢氧化钠溶液混合,都恰好完全中和,说明两种酸的物质的量相等,根据物质的量、物质的量浓度和溶液体积的关系式判断浓度相对大小.
D、根据溶液的pH值确定水电离出氢离子浓度的相对大小.
A、盐的类型不同导致盐溶液的酸碱性不同.
B、弱电解质部分电离.
C、2a L醋酸和a L盐酸分别与b L物质的量浓度为c mol?L-1的氢氧化钠溶液混合,都恰好完全中和,说明两种酸的物质的量相等,根据物质的量、物质的量浓度和溶液体积的关系式判断浓度相对大小.
D、根据溶液的pH值确定水电离出氢离子浓度的相对大小.
解答:解:2a L醋酸和a L盐酸分别与b L物质的量浓度为c mol?L-1的氢氧化钠溶液混合,都恰好完全中和,说明酸和碱的物质的量相等.
A、醋酸钠是强碱弱酸盐水解呈碱性,氯化钠是强酸强碱盐不水解,所以两种溶液的酸碱性不同,即溶液的pH不相等,故A错误.
B、醋酸是弱酸只有部分电离,氯化氢是强电解质全部电离,所以盐酸和醋酸电离产生的阴离子的物质的量不相等,故B错误.
C、2a L醋酸和a L盐酸分别与b L物质的量浓度为c mol?L-1的氢氧化钠溶液混合,都恰好完全中和,说明两种酸的物质的量相等,醋酸的体积是盐酸的2倍,要使醋酸和盐酸的物质的量相等,则盐酸的浓度是醋酸的2倍,故C正确.
D、通过C知,盐酸的浓度是醋酸的2倍,氯化氢是强电解质,醋酸是弱电解质,所以醋酸溶液的pH值大于盐酸,醋酸溶液中氢氧根离子浓度大于盐酸,水电离的氢离子和溶液中氢氧根离子浓度相等,所以盐酸由水电离出来的c(H+)比醋酸溶液中由水电离出来的c(H+)小,故D错误.
故选C.
A、醋酸钠是强碱弱酸盐水解呈碱性,氯化钠是强酸强碱盐不水解,所以两种溶液的酸碱性不同,即溶液的pH不相等,故A错误.
B、醋酸是弱酸只有部分电离,氯化氢是强电解质全部电离,所以盐酸和醋酸电离产生的阴离子的物质的量不相等,故B错误.
C、2a L醋酸和a L盐酸分别与b L物质的量浓度为c mol?L-1的氢氧化钠溶液混合,都恰好完全中和,说明两种酸的物质的量相等,醋酸的体积是盐酸的2倍,要使醋酸和盐酸的物质的量相等,则盐酸的浓度是醋酸的2倍,故C正确.
D、通过C知,盐酸的浓度是醋酸的2倍,氯化氢是强电解质,醋酸是弱电解质,所以醋酸溶液的pH值大于盐酸,醋酸溶液中氢氧根离子浓度大于盐酸,水电离的氢离子和溶液中氢氧根离子浓度相等,所以盐酸由水电离出来的c(H+)比醋酸溶液中由水电离出来的c(H+)小,故D错误.
故选C.
点评:本题考查了弱电解质的电离、混合溶液pH值的判断等知识点,注意D选项中水电离出的氢离子浓度不大于溶液中氢离子浓度,为易错点.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
 C(g) △H= - a kJ·mol-1
C(g) △H= - a kJ·mol-1 (C) =
(C) = 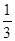 ,则b = ____________。
,则b = ____________。